Законът за запазване на масата вещества, открит MV Ломоносов през 1756 със следното съдържание:
Масови вещества нереагиралите вещества равно тегло в резултат на това.
Масови материални носители вещества атоми на химични елементи, от които се състоят от двете вещества, вписани в реакцията (реагентите) и формира в резултат на новите вещества (реакционни продукти). Защото химически реакции атоми са образувани п не са унищожени, а само е тяхното прегрупиране, става очевидно, правосъдие, отворена MV Ломоносов и по-късно потвърдена от Лавоазие право.
Валидността на закона за запазване на масата на веществото може лесно да се види на един прост опит. Сложете в малка колба от червен фосфор, ще затвори своя запушалка, а тежи на косъм. След това колбата внимателно се загрява.
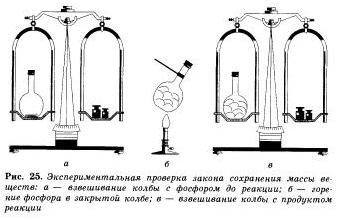
Фактът, че не е химическа реакция. Ще стане ясно от появата на гъста бяла дим в колбата се състои от фосфорен оксид (V). който се образува, когато фосфор реагират с кислород. Чрез повторно претегляне на колбата с реакционните продукти на това ние виждаме, че масата на материал в колбата се промени, въпреки че фосфор превръщане до неговата оксид.
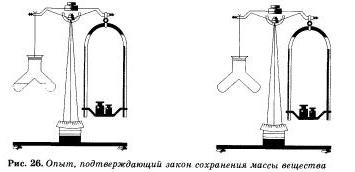
Това заключение е направено от нас, и по време на още една проста, но много визуално преживяване. В специален съд излива отделно солна киселина и алкален разтвор, например натриев gidrokspda. Към разтвор на основа, за да добавите няколко капки индикатор - фенолфталеина, вкарвайки на решение ще се превърне пурпурен цвят. Затворете устройството запушалка, за да се балансира теглото на бележка маса мащаб, а след това се сливат решения. Пурпурният оцветяване изчезне, защото киселина и алкални и взаимодействат един с друг. Масата на кораба с реакционните продукти, получени не се променят.
Въз основа на този закон, написани на химични оферти, т.е. равнява химически реакции с помощта на химически думи - формули.
химично уравнение се нарича условно запис на химическа реакция с химични формули и математически символи.
Уравнението на левия чест записва формула (формула) вещества, нереагиралите, да ги свърже с знак плюс. В дясната страна на уравнение е написан на формула (формула), образуващи вещества също са свързани със знак плюс. Между части на уравнението постави стрелката. След това намерете коефициентите - на облицовъчни материали формули, че броят на атомите на едни и същи елементи в лявата и дясната страна на уравнението са равни.
Пишем, например, следната реакция уравнение:
Тъй като броят на кислородните атоми в първата част е два пъти в ляво, можем да пише до съотношение вода формула 2:
2H2O -> Н2 + O2
Но сега в лявата част на уравнението е четири водородни атома, както и правото на тяхното оставащите две. За изравняване на броя на водородните атоми да напише своята формула в дясната страна като фактор на 2. Тъй като ние се равнява на броя на атомите на всеки елемент в лявата и дясната страна на уравнението, ние замени стрелката на знак за равенство:
2H2O = 2Н2 + O2
Сега може би ще се разбере защо този запис се нарича уравнението.
Чрез химични реакции на уравнения може да се определи вида на реакцията. По този начин, обсъдени по-горе реакция се отнася до реакцията на разлагане на I, която е такава, за която комплекс вещество ил образува две или повече нови вещества от прости или сложни, но по-прост състав.
При разлагане, например железен хидроксид (III) са оформени от железен оксид (III) и вода:
Химични реакции се наричат срещу тип реакции съединение. В реакцията на съединението влиза един или повече прости или сложни вещества, едната от които образува комплекс повече вещество.
Например, водород и кислород при изгарянето комбинират, за да образуват вода:
Това се отнася до реакционната съединение и преди обсъдени реакцията контакт за получаване на железен сулфид (II) желязо на прах и сяра. Интересното е, че реакцията на свързване и реакцията на разлагане придружава от противоположни топлинни ефекти: взаимодействие на съединение обикновено са екзотермична. и реакцията на разлагане - с ендотермичната.
Ако разтвор на меден сулфат (II) за понижаване на желязо файл, много скоро става червен поради утаява нея меден сулфат и желязо (II) ще премине в разтвор:
CuSO4 + Fe = FeSO4 + Cu
Ние записва уравнение реакция заместване, т.е. реакция в който атомите прилагане на прост вещество от заместителите NE елементи комплекс значение.
В резултат на тази реакция, две нови вещества - прости и сложни.
Чрез метатеза реакции включват тези, в които две комплексни вещества обменят техните съставни части.
Например, към разтвор на меден сулфат меден сулфат (II) разтвор Кор няколко капки edkoyu хидроксид - натриев хидроксид, попада синьо утайка от меден хидроксид (II). Това представлява допълнително комплекс вещество - разтворима сол на натриев сулфат:
Ако разтворът получената утайка пренапрежение сярна киселина, след това се наблюдава разтваряне на утайката, получена в резултат на друга реакция обмен:
Cu (OH) 2 + H2SO4 = CuSO4 + 2HOH
Поради това уравнение показва химическа реакция, която вещества реагират и които по този начин вещества са оформени в която количествени отношения са и какъв вид на реакцията.
Например, уравнението
4Al + 3O2 = 2Al2O3
Това показва, че съединението Получената реакционна четири мола алуминий взаимодейства с три мола кислород и по този начин образуват два мола алуминиев оксид.
1. химически уравнение.
2. Реакциите на разлагане.
3. Реакциите съединение.
4. заместващите реакции.
5. реакции обмен.
Запишете под формата на химически уравнения на следните изречения: а) За калциев карбонат образува печене калциев окис и въглероден оксид (IV)
б) В реакцията фосфорен оксид (V) с вода получава фосфорна киселина. Какъв тип тези реакции? Кой от тях ще бъдат екзо- и ендотермични какво?
Направи уравнението на следните схеми и изберете типа на реакция:
По формулите на веществата пишат имената си. Напишете химичните реакции в следните схеми:
а) фосфорна киселина + натриев хидроксид -> натриев фосфат + вода;
б) натриев оксид + вода -> натриев хидроксид;
в) железен оксид (II) + алуминий -> алуминиев оксид + желязо;
ж) хидроксид, меден (II) -> оксид, меден (II) + вода.
Посочете вида на реакция.
Което показва следната химическа реакция уравнение:
Какво количество водород взаимодейства с 1 мол железен оксид (III)? Какво обем от водород реагира с 1 мол железен оксид (III)? Какво е количеството на желязото по този начин? Колко вода молекули в същото време имаме?
Ако имате корекции или предложения на този урок, моля свържете се с нас.
Ако искате да видите и другите корекции и предложения за уроци, погледнете тук - Образователен форум.
Свързани статии
