Електронни ефекти - смяна на електронната плътност в молекулата, йонен или радикал под влиянието на заместители.
Заместителят е всеки атом (различни от водород) или група от атоми, свързани към въглеродния атом.
Разграничаване между индуктивни и мезомерни електрон ефекти на заместители.


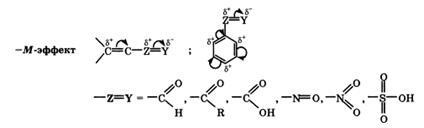
+М-ефект е типично за групите -OH и -NH2. -M ефект с електроотрицателните заместители показват атоми и повлияе плътността електрон. -M-ефект е типично за групите -СН = О, -СООН, -NO2. Въпреки че тези групи имат самотен електронна двойка, пространственото подреждане на орбитите на тези електрони не им позволява да се влиза в системата на сдвояване. Така, в този случай заместителят може да забави само електроните от общ интерфейс системата поради своята висока Електроотрицателност.
Киселинността и алкалността на органични съединения.
За оценка на киселинността и алкалността на органични съединения, най-важните са две теории - Теория и теория Bronsted Люис.
Според теорията на Люис, киселини и основи свойства на съединенията се определя чрез тяхната способност да приемат или да електронна двойка, за да образуват връзка. В съответствие с принципа на HSAB киселина и Люисова база са разделени в твърди и меки.
Люисови киселини могат да бъдат атоми, молекули или катиони имат свободен орбитален и способен да приеме една двойка електрони, за да се образува ковалентна връзка.
Люисова киселина - акцептор двойка електрони; Lewis бази - донор двойка електрони. Люис база (атом, молекула или анион) трябва да има поне една двойка от валентните електрони, те са способни да осигурят партньор за образуване на ковалентна връзка. Всички бази Lewis са нуклеофилни реагенти.
На теория Bronsted (протолитично теория) на киселинност и алкалност на съединенията е свързано с прехвърлянето на протонна Н +. Киселина и основа се образува конюгат киселина базова двойка, в която силна киселина, по-слабите конюгата го базова позиция, и обратно, по-силна база, по-слабата му конюгатна киселина.
Bronsted киселина (протонна киселина) - йони или неутрални молекули, способни да отдаваща протон (протонни донори).
Основи на Bronsted - неутрални молекули или йони, способни на свързване протон (протон акцептори).
Киселинността и алкалността не са абсолютни, но относителните свойства на съединенията: киселинни свойства са открити само в присъствието на основа; основни свойства - само в присъствието на киселина. Като разтворител в изследването на киселина базови равновесие се използва обикновено вода.
В зависимост от естеството на елемент е свързан с про-тон разграничи ОН киселина (карбоксилни киселини, феноли, алкохоли), SH-киселина (тиоли), NH-киселина (амини, амиди, имиди), СН-киселина (въглеводороди и тяхната про-вода). Един елемент и свързаните с него киселинен водороден атом център повикване. Във всички случаи има изместване на електронната плътност от водороден атом, към по-електроотрицателна атом, протон повече или по-малко лесно отцепена. Колкото по-висока Електроотрицателност елемент е свързан с протон, по-голямата киселинността на съединението (например, карбоксилна киселина е по-силна киселина от тиоли или амини).
Наличието на електрон-привличащи групи в молекулата, като отрицателни електронни ефекти, увеличава положителния заряд на протон, което води до повишаване на киселинни свойства.
За образуване на ковалентна връзка с протона на основата Bronsted трябва да предостави или свободна двойка електрони или електрони р-комуникация. В съгласие с това sponds-Bronsted база е разделена на базата на п и р-база.
на базата на п могат да бъдат неутрални или отрицателно по-маскиране. Обикновено анионите имат силна експресия-долепени-основен характер от неутрално вещество. Това е, амид йон, NH2 - или хидроксиден йон HO - алкалност на високо амоняк NH3 и вода H2O
В р-тип субстрати, които включват алкени, алкадиени, арена, център на основните, че е място електрони протон закрепване са р-комуникация. Това е много слаба основа, както протонирани електронни двойки и не са свободни.
Наличието на електрон отдаваща заместители увеличава алкалността на органични съединения.
1. зависимост от киселинността на хетероатомите.
По природа хетеро разбере Електроотрицателност (ЕО) и поляризуемост. Колкото по-(EO) се извършва по-лесно хетеролитична разликата в молекулата. В периодите от ляво на дясно с увеличаващите се увеличава ядрените тарифите (E.O), т.е. способност на елементите са с отрицателен заряд. В резултат на преместването на връзката на електронната плътност между атоми поляризирани. Колкото повече електрони и по-голямата атомната радиус, по-нататъшните електроните външни ниво на енергия са от ядрото, по-високата поляризуемост и висока киселинност.
Пример: СН- NH- ОН- групи SH-
увеличение на ЕО и киселинност
С, N, О - елементи на един период. EO срокът се увеличава, увеличава киселинността. В този случай, поляризуемост отрази на киселинността няма.
В поляризуемост на атомите в промените в период леко, така че основният фактор, определящ киселинността е EO
А сега да разгледаме ОН групи SH-
О, S - са в една група, в групата на отгоре надолу радиус се увеличава, като по този начин се увеличава и атомен поляризуемост, което води до увеличаване на киселинността. U S атом радиус по-голям от този на О, обаче проявяват силен тиоли киселинни свойства, отколкото с алкохоли.
2. Ефект на въглеводородни радикали и заместители, присъстващи там
Електрон (ЕА) заместители допринасят за изместването на електронната плътност, което води до стабилността на анион и съответно увеличаване на киселинността.
донор на електрони (ED) заместителите на напротив допринасят за концентрацията на електронната плътност в центъра на киселина, което води до намаляване на киселинност и алкалност увеличение.
Взаимодействие на молекули или йони на разтвореното вещество в процеса на разтворител наречен солватиране. Анион стабилност зависи основно от неговото разтваряне в разтвор: колкото по-висока солватирания йон, така че е стабилен и разтваряне на по-голяма, колкото по-малък размер на йон и по-малките и изместването на отрицателния заряд в него.
Свързани статии
