Всички тъкани животински и растителни са съставени от различни химически съединения: протеини, въглехидрати, мазнини и витамини. Въпреки, че тези вещества са необходими за нормалното развитие на тялото, най-важните са протеини. Те служат на основния въпрос, на който всички отделни клетки и на целия организъм. Протеините са най-висшата степен на развитие на материята, както и с всички тях неразривно свързани безброй разнообразни прояви на живот, като се започне с най-простите функции на най-примитивните създания на сложни функции човешката дейност.
структура на протеина. Има прости и сложни протеини. Обикновено протеин момента се разглежда като продукт на поликондензация на аминокиселини, т. Е. Като природен полимер. Комплекс протеини се състоят от единичен протеин и протеинови компоненти - въглехидрати, липиди, нуклеинови киселини и други съединения.
Общо за всички протеини е, че техните макромолекули, съставени от стотици единици свързани помежду си така наречената пептидна връзка, със структура
По своята същност, всяка връзка - останалата част от една от аминокиселините. Те образуват полипептидни вериги, всяка от които съдържа десетки или дори стотици различни аминокиселинни остатъци. Всички други аминокиселини, които изграждат протеин са # 945-амино киселина, в която амино групата NH2 е свързан към същия въглероден атом, който е свързан и карбоксилната група СООН. Всички а-амино киселина (с изключение на хетероциклен) може да се изрази в общия предния muloy
където R - въглеводороден радикал.
Аминокиселините се различават един от друг не само в количество, но също така и броят на техните съставни NH2 и СООН групи, както и наличието в тяхната структура на атома на други елементи като S, Br, I. В момента има около 26 различни аминокиселини, принадлежащи към на протеини. Приблизително половината този брой има само една група от NH2 и СООН; те са прости, или monoaminokislotami. Други включват две СООН групи за амино група и притежават характерни киселинни свойства. Третата група от аминокиселини е изразен основни свойства, съдържа едно СООН група НС две амино групи. Освен това, в състава на протеини включва някои S-циклични киселини с по-сложен състав и структура на радикала R.
За първи път най-прост протеин структурата на схемата е даден от Fisher (1906) под формата на полипептидна верига.
кондензационни реакции се провеждат съгласно следното уравнение
Именно чрез комуникация на полипептида е допълнително образуване на полимери на протеини на сложност. Тъй като броят на аминокиселинни единици в молекулите и полипептидите увеличава броя на възможните изомери. По този начин, английски биохимик Richard Sindj Изчислено е, че протеин с молекулно тегло от 3400 (относително къса верига), всяка молекула, която съдържа 288 аминокиселинни остатъци и структурата включва само 12 аминокиселини, могат да имат напълно астрономически брой изомери - 10 300. Ако една могат събират само една молекула на всеки от възможните изомери на този хипотетичен протеин, общата маса на тези молекули би довело до 10,277 кг. Тъй като земята е значително по-малка маса, изчислена tsifroy- 24 октомври кг - очевидно, че действително съществува в природата само няколко изомери на този втори протеин.
Броят на протеини, които се срещат в природата, е изключително голям. В настоящото време инфузия на няколко стотици различни протеини, изолирани в чиста форма. А проучванията показват, че общият брой на протеини, които се различават помежду си в своите химични свойства, във всеки жив организъм достига няколко хиляди. Често дори изглеждат абсолютно еднакви протеини от различни източници не винаги са идентични по състав и структура. По този начин, всички многообразието от форми на живот на нашата планета, поради наличието на няколко милиона индивидуални белтъци, всяка от които е уникална по рода си.
макромолекулата на протеин е много сложна система. Неговите повтарящи се единици са така наречените макромолекули, във всеки от които включва пептидна верига на 4-6 аминокиселини и образуването на цикличен (пръстен дикетопиперазин).
По този начин, съставът на протеини са сложни полипептиди структурно и - високомолекулни полимери (vysokopolikondensaty).
Както се вижда от многобройни изследвания, не само аминокиселината в полипептидната верига, всеки мястото му, но самите вериги на протеини са подредени в правилен ред. Достатъчно безпокойте подреждане на веригите в молекулата като протеин и умират промяна. Заедно с пептидна връзка в протеинова молекула, има и други форми на комуникация, по-специално водород. В резултат на това макромолекула протеин е основно придобива характера на един много силен образование.
Многобройни проучвания са установили, че всички протеини във формата на техните макромолекули могат да бъдат разделени главно в две групи - фибриларен и кълбовидни.
Фибриларни или влакнести протеини (от латински fibrilla дума - влакна) се състоят от макромолекули, под формата на тънки удължени нишки, обикновено свързани помежду си. Тази група включва протеини, които са съставки на кожата и сухожилията (колаген, желатин), косата и рог (кератинови), мускулна (миозин) и други. В тялото, те действат предимно механични функции, въпреки че някои фибриларни протеини притежават биологична активност , Така че посочената по-горе миозин е ензим; го разцепва adenazintrifosfornuyu киселина (АТР), което има голямо количество енергия освобождава, когато неговото разцепване.
Фибриларни протеини при стайна температура е обикновено неразтворими във време де, но са способни на подуване в него, който говори за техните хидрофилни свойства.
Кълбовидните протеини (от латинската дума globula - топка) се състоят от макромолекули, сферични, елиптични, рядко вретеновидно. Характерна особеност на тези протеини е добра разтворимост във вода, т.е.. Е. висока хидрофилност. Кълбовидните протеини са открити най-вече в телесните течности: кръв, лимфа, цитоплазмата на клетките. Протеините от тази група - албумин и глобулин яйчен белтък, мляко, серумни, стомашен сок пепсин и други - извършват в организма е много важни биологични функции.
Многобройни опити са показали, че естеството на връзките в влакнести и глобуларни протеини е идентичен. Молекулното тегло както на основните структурни протеини видове е приблизително същата (от 30 000 до 1 000 000 или повече), но формата е значително различна. Така че, в фибриларни белтъци makroglobul дължина стотици и хиляди пъти по-големи от дебелината им. Например, makroglobula проколаген с молекулно тегло 680 000 има дължина от около 30 пМ, а дебелината - само няколко десетки нанометра.
протеинови глобули. За стабилността на колоидни частици има стойност само вода, което създава външния кожух вода. Това беше тя, и предпазва от сблъсък и асоциация на протеинови макромолекули.
Комплекс протеини се състои от прост makroglobuly протеин, към който са прикрепени, други компоненти: .. въглехидрати или липиди, фосфорна киселина и т.н., принадлежат към тази група, както нуклеопротеини и чиято структура е особено интензивно изследван наскоро. Припомнете си, че нуклеопротеини състоят от така наречените протеин и нуклеинова киселина, която е полимер, състоящ се от мононуклеотиди (мономери), свързани заедно чрез естерни връзки. Всеки от мономерите е пуринова (аденин или гуанин) или пиримидин (тимин, цитозин или урацил) основи свързани чрез рибозата или dizoksiribozu с фосфорна киселина. Специално znĂ-chenie получаване на биологичната електрически заряд на протеини, в допълнение към тяхната особена структура, е характеристика на техните свойства. Молекулата на протеин съдържа две полярни групи: основни - NH2 и киселината - СООН, който съобщава макромолекулни амфотерни свойства. Протеините не са просто електролити и електролити - амфолити. Това означава, че във водни разтвори на макромолекули могат да разграничи като киселини, т.е.. Д. С елиминиране на водородни йони
и като база, т.е.. е. с елиминиране на хидроксилни йони
протеинови макромолекули имат спирала конфигурация, която може да варира в зависимост от знака на заряда. По този начин, протеин в неутрално състояние на противоположно заредени йони NH3 + и COO - чувстват силно влечение към друг, като по този начин причинява съкращаване протеинови нишки и дори я усукване в спирала:
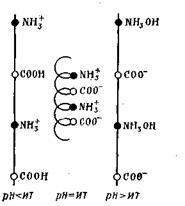
Киселият и алкална среда отблъскване на отделните групи и разтягането на веригата като цяло, т.е.. Е. развиване спирала.
По този начин, протеин зареждане зависи от съотношението на молекулите карбо-ksilnyh и амино групи и рН на средата. РН на разтвора на протеин, при което протеинът превръща електрически неутрален, се нарича изоелектричната точка на протеина. Всеки протеин има рН, при което е тучни-изоелектрично състояние в ditsya (Tabl.6.5).
Таблица 6.5 Опитът показва, че в състояние вискозитета изоелектричната малките протеини. Това се дължи на промяната във формата на макромолекули, тъй макромолекули в несгънато положение дава разтвори на по-висок вискозитет от макромолекулата, навити на спирала или спирала.
Опитно определяне на изоелектричната точка на протеинови разтвори като изоелектрично държавни определяне lyophobic золове, преки или косвени методи може да се получи.
Директни методи са сведени до наблюдение на поведението на частици в електрическото поле при електрофореза. В този случай целевия протеин се подлага на електрофореза в буферни разтвори с различни стойности на рН. Буферният разтвор с рН от изоелектричната точка на протеина, като последният е електрически неутрален и не мигрират в електрическо поле. Тези наблюдения се провеждат или макроскопски по-специално електрофоретични устройства или микроскопски в клетка ultramicroscope. В допълнение към директните методи за наблюдение съществува изоелектрично състояние протеин и косвени методи, които са сведени до наблюдението на максималната или минималната на физическо свойство, което варира в зависимост от промените в зета потенциал на разтвора за изпитване. Всички тези методи са описани подробно в съответните ръководства.
Свързани статии
