Механизмът на действие на ензимите
Ензимна катализа проявява протеин природата на ензими, тяхното thermolability, ефектът на рН, специфичността на действие, висока каталитична способност, чувствителност към инхибитори и активатори. Ензимната реакция се извършва в съответствие със закона за действието на масите.
Ензимите и активиращата енергия. Ензимите - са биологични катализатори. Те засягат скоростта на реакцията в двете посоки ускоряване на синтеза или разцепване на някои вещества. Увеличаването на скоростта на реакцията се дължи на промени в молекули субстрати за активиране на енергия. активиране енергия Е характеризира енергийна бариера, която трябва да се преодолее, за да доведе реагентите на активно състояние. Тя се причинява от междумолекулно сила междумолекулно свързване или отблъскване на реагентите. Скоростта на реакцията може да се увеличи чрез увеличаване на броя на активираните молекули или намаляване височината на енергийна бариера.
Субстрат молекули могат да бъдат въведени в активно състояние чрез различни методи. Един от тях се нагрява, при което в разтвора с увеличаваща се скорост на молекулите и възможността за контакт. Когато присъствието на катализатора се намалява и енергията на енергийна бариера активиране (цвят. Таблица. IV). По този начин, разцепване на захароза в глюкоза и фруктоза под влиянието на сярна киселина Е = 134 400 J / мол, и с участието на инвертаза - 40420 J / Mol. За хидролиза със солна казеин
киселина Е = 109 200 J / мол, пепсин - 50 400 J / мол. (. Фигура 40) енергията на активиране на разлагане на водороден пероксид без катализатор е 75 600 J / мол (Е1), с колоиден платина - 49 140 (Е2), черен дроб каталаза - 23 100 J / мол (E3).
Теорията на ензимната катализа. катализа процеси по-пълно обясняват теорията на Michaelis - Menten. Според тази теория, има четири етапа.
Аз етап. Между субстрата (S) и ензимът (Е), има връзка - формира ензим-субстрат комплекс на ES, в която компонентите са свързани чрез ковалентна, йонни, водород и други връзки.
Етап II. Субстратът приложен под въздействието на ензима се активира, които са налични за съответните катализ реакции ES.
Етап III. Проведени катализ ES *.
Етап IV. E освободени ензимни молекули и реакционни продукти P.
Последователността на трансформации отразява следната схема:
Теорията на ензимната катализа потвърдено експериментално. Например, хрян изолиран ензим, който разцепва водороден прекис - пероксидаза кафяво. След ензим Е с субстрат съединение Н 2О 2 (S) на там е ензим-субстрат сложни ES зелено. След известно време на субстрата се активира, за да се образува активиран ензим-субстрат цвят ES * червеникаво. Той се разделя на кафяво ензим Е и продуктите на разпадане P.
Активното място на ензима. ензимни частици
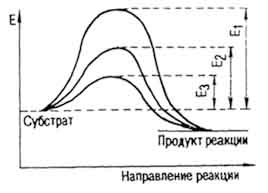
Фиг. 40. Намаляване на активиране на енергия с катализатор (за Е. Хофман)
има големи резерви на свободна енергия и може да се адсорбира върху молекулите на повърхността или части субстрати, размерите на които в повечето случаи е много пъти по-малък от размера на молекулата на ензим. В реакцията на ензим и субстрат частиците променя неговата конфигурация - като особен вдлъбнатина и в която се образува ензим-субстрат комплекс. Тази част от молекулата на ензим, наречен substratsvyazyvayuschim част. В разпределя част от молекулата на ензим извършване катализа, - активното място. Остатък е ензим, който се свързва метаболити ниско молекулно тегло или ефектори променят неговата третична структура и инхибира активността на ензим, наречен алостеричен център. Повечето ензими има един, някои - две или повече активни сайтове. Substratsvyazyvayuschy и активни центрове често са географски съвпадат. Молекулите на трипсин и карбоксипептидаза имат един активен център, глицералдехид - 2, уреаза - 3-4, холинестераза - 20-100.
Активното центъра съдържа групи, които носят тясно взаимодействие между частиците на субстрата и ензима. Те са в състояние да намали енергията активиране за образуване на първи комплекс на ES, ES * и след това, най-накрая, Е и P. С прости ензими в образуването на активния център на протеин участва функционални групи в сложни ензими - и съответните кофактори. Аминокиселинните остатъци в активния център могат да бъдат разделени в три вида. Някои от тях носи групи, действащи върху субстрата по време на катализа, други правят контакт между ензима и субстрата, третата работи чисто структурна роля в поддържането на третичната структура на молекулата на ензим. По време на каталитичен случай е вид, индуцирана от "изрязване" субстрата (понякога инхибитор) към активното място (фиг. 41).
Химията на активното място на взаимодействие със субстрата най-широко изследван за ацетилхолинестераза (AChE). Това се отнася до прости ензими. (. Фигура 42 А) на активния център на неговата молекула съдържа най-малко четири аминокиселинни остатъци: серин, хистидин, тирозин и глутаминова киселина. В етап I
Фиг. 41. Схема индуцирана "подходящи" на ензим и субстрат ензим и инхибитор) от D. В. Moss, J. L .. Vattervortu)
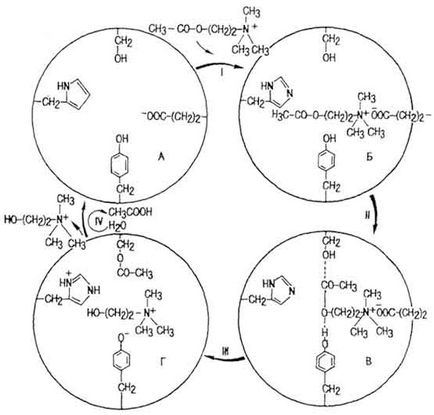
Фиг. 42. Механизмът на действие на холинестераза (като YB Филипович)
AChE когато взаимодейства с невронни възбуждане медиатор ацетилхолин (AX) ензимен комплекс настъпва - AX (Фигура 42, Б.). В етап II комплекс се активира чрез взаимодействие на серин и тирозинови остатъци на активния център на молекулата и AX (Фиг. 42 В). енергийна бариера понижено (има ES *). В етап III под влиянието на радикала на хистидин извади протон от хидроксилната група на тирозин, образуване на естерна връзка между остатък серин и група AX ацетил, прекъсва връзката между остатък на оцетна киселина и остатъкът на холин (фиг. 42, L. На етап IV се хидролизира ES * комплекс _L U. извличане на активния център на AChE, отличаваща холин и оцетна киселина. Хидролизата AX настъпва при висока скорост. по този начин, част от AX 1-2 мкг унищожени за 0, 1-0, 2 милисекунди.
Кинетиката на ензимни реакции. Всяка химическа реакция протича при определена скорост. Биологични задача ензими се изпраща увеличаване на скоростта на химични реакции. Тези процеси се обучават ензимната кинетика.
Ензимни кинетика - точка на химичните Кинетика, изучаващи зависимостта на скоростта на ензимни реакции от химическата природа на реагентите (субстрати, ензими) и условията за тяхното взаимодействие (концентрация на компонентите, рН, средно състав, температура, активатори действие или инхибитори, и др.). позицията му позволява да се оцени процеса на ензимно и се отнася до повлияе курса. Нека се спрем на основните.
Има няколко типа ензимни реакции .. Необратими реакция с един субстрат, обратима реакция с един субстрат, необратима реакция с двата субстрата, и т.н. Най-често необратима реакция с един субстрат.
В последния случай, на ензим Е взаимодейства първо с субстрат S, което води до образуването на ензим-субстрат сложни ES (в много реакции -dvuh или повече комплекси). комплекс ензим-субстрат се характеризира с Скорост на образуване на константа на реакционната к + 1 и скорост на реакцията постоянно к-1 разлагането на.
комплекс ензим-субстрат е характеристика на константата на субстрат, или постоянна Ks дисоциация.
Количеството на субстрата постоянно зависи от естеството на субстрата и ензима. При същите началните концентрации на ензима и субстратна концентрация на комплекса [ES] ще бъде толкова по-големи, по-малка е стойността Ks.
Субстрат постоянна определя степента на афинитет на ензима и субстрата. Така че, за инвертаза Ks = 0,0167. Има fermentsubstratnogo комплекс концентрация превишава концентрацията на свободен ензим и субстрат е приблизително 60 пъти.
Във втората фаза на ензимната катализа на ензим-субстрат комплекс се разлага и Е на продукта ензим реакция P.
Двете фази на ензимната катализа са комбинирани в типичен на необратими реакции с субстрат:
система к, + 2 е константата на скоростта на разпадане на ензим-субстрат комплекс на ензим и реакционен продукт P.
За пълно описание на процеса на ензимно с помощта на постоянно Км Michaelis. Той изразява съотношението на константите на трите реакции показано в системата
Числов израз Km винаги малко по-голям от Ks. По този начин, Ks стойност за ензим-субстрат комплекс сукраза - захароза равно на 0,0167 и стойност CR - 0,0280 мол / л. Кт за различни ензими варира.
Скоростта на ензимни реакции, изразена в катодната (CAT). Хвърлена - каталитична активност на ензима, способен да извърши реакцията при скорост от 1 мол / и в измерване на предварително определена система активност. Català -mikrokatali производни са често използвани (МАЬ), nanokatali (nkat) или pikokatali (pkat), което съответства на скоростта на реакциите, изразени в микромола и пикомола наномола в секунда.
Скоростта на ензимната реакция се определя от условията на възникването му. Например, при оптимални условия (пълно насищане на ензимния субстрат, желаното рН, температура 25 ° С или 37), то ще бъде максимално или първоначално, и е обозначен с V. Тази скорост се характеризира с постоянна скорост на разпадане на комплекс и ензим концентрация на ензим-субстрат:
За ензимната реакция, което се случва, когато има недостатъчно насищане ензим, субстрат, наблюдаваната скорост характеристиката # 957;. Тя се определя от продукта на константата на скоростта на разграждане на ензим-субстрат комплекс да се образува реакционен продукт Р и концентрацията на ензим-субстрат комплекс:
Ако приемем, че
По този начин, степента на ензимна реакция е пряко пропорционална на константата на скоростта на разпадане на ензим-субстрат комплекс да се образува реакционен продукт, концентрацията на ензимния субстрат и субстрата е обратно пропорционална константа.
За определен етап концентрация реакции [ES] е постоянна. Когато [S]> [Е], след това
Прилагането на константа Михаелис, уравнението може да бъде опростено:
наблюдава Скоростта на реакцията може да се изрази чрез уравнението
Чрез повишаване на концентрацията на субстрат [S], където [S]> Km.
Тук скоростта на ензимната реакция се доближава до максимум. Скоростта на реакцията може да се опише чрез уравнението на Michaelis - Menten:
От уравнението следва, че за нисък субстрат концентрации скоростта на ензимната реакция зависи линейно от [S], и при много високи субстратни концентрации тя се доближава до максимална скорост Vm и вече не промени с увеличаване на [S]. Уравнението показва също, че ако
ниво [S]> [Е] Скоростта на реакцията е пропорционална на концентрацията на ензима Е.
Свързани статии
