През 1903 г., В. Хенри заключи, че е необходимо етап е ензимна катализа на свързване на ензима към субстрата, при което се образува ензим-субстрат комплекс. Развитието на тази идея доведе до създаването на общата теория на ензим действие; особено голям принос за това през 1913 година. направени от L. Michaelis и М. Menten. Съгласно хипотезата, процесът на ензимната катализа могат да бъдат разделени в три стъпки:
1) дифузия на субстрата към ензима и пространствено неговото свързване към активното място на ензима, т.е. образуване на ензим-субстрат комплекс (ES);
2) превръщане на първичната комплекс в един или повече от активиран ензим-субстрат комплекс (ES *, ** ES ...);
3) отделяне на продуктите (Р) взаимодействие на активния център и неговото разпространение в околната среда.
Първият етап е обикновено с кратка продължителност и зависи от концентрацията на субстрата в средата, и дифузията на активното място на ензима. Комплексът се образува почти мигновено. Субстратът е прикрепена към активното място в няколко точки, които хелат (грайферни) комплекси. Присъединяването се осъществява от различно естество връзки, предимно слаб (водород, електростатични, хидрофобен, координация), ковалентни връзки са рядкост. На този етап, промени в енергията на активиране на леко, ориентацията на субстрата и на активното място и насърчава сближаване с реакцията.
Вторият етап ограничава бавната скорост и цялата катализа цяло. Неговата продължителност зависи от енергията на активация на химичната реакция. На този етап, субстратът разхлабване връзки, тяхното разкъсване или образуване на нови връзки чрез реакция с активните групи на ензима. Поради образуването на активирани комплекси на преход намалява активиращата енергия на реакцията.
Третата стъпка е почти мигновен. Тя се определя от скоростта на разпространение на продуктите на реакцията в околната среда.
Естеството на силите, които се стабилизират на различните структурни състояния fermentsubstratnogo комплекс
Обратимите молекулни взаимодействия в биологичните системи е, медиирани от три вида. Сгъваем на макромолекули в сложна структура, субстрата да се свърже към ензима, клетка-клетка взаимодействието, т.е. всички молекулни взаимодействия в биологичните системи се извършва чрез образуване на водородни връзки, и връзките, причинени от електростатични и ван дер Ваалс взаимодействия. Трите основни видове нековалентни връзки се различават в тяхната геометрия, сила и специфичност. Освен това, въпреки че те vsegdasilno засяга присъствието на вода, но ефектът е различен. Нека разгледаме всеки един от тези основни типа връзки.
електростатични взаимодействия
Натоварени Субстрат група може да реагира с ензим група носещ противоположен заряд. Силата на електростатично взаимодействие се определя от закона на Кулон:
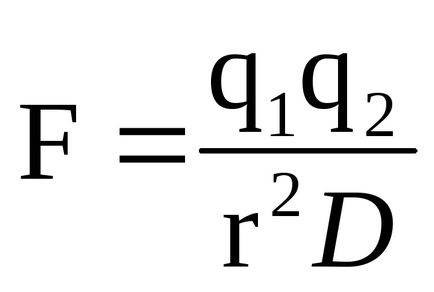
където Q1 и Q2 - такси на съответните групи, R - разстоянието между тях, D-диелектрична константа среда. Електростатично взаимодействие е най-силно изразена във вакуум (където D = 1) и най-лошо - в среда, като вода (където D = 80).
Пример за електростатично взаимодействие може да бъде свързването на глицил-Ь-тирозин с карбоксипептидаза А - протеолитичен ензим, който разцепва аминокиселинни остатъци С-терминал. Отрицателно заредени терминална карбоксилна група на основата на дипептид взаимодейства с положително заредена гуанидино групата на аргининови остатъци на ензима. Разстоянието между двете противоположно-внезапни-конюгиран групи е 0.28 пМ:
Този тип взаимодействие се нарича йонна връзка. сол връзка. сол мост или йонна двойка. Всички тези термини имат същото значение: elektrostaticheskoe взаимодействие между противоположно заредени групи. Между отрицателно зареден субстрат и положително заредена странична верига на лизин или аргинин остатък може да има електростатични взаимодействия. Ако рКа на имидазол групата на хистидинов остатък или терминалната амино група на полипептидната верига се гарантира тяхната положителен заряд при рН на средата, те също могат да функционират като потенциален свързващ сайтове-vanija отрицателно зареден субстрат. В случая, когато субстратът има положителен заряд, потенциални места на свързване са отрицателно заредени карбоксилни групи на аспартат и глутамат, и крайната карбоксилна група на полипептидната верига.
Свързани статии
