Всичко, което се вдишва въздух, който е предимно азотни и кислородни молекули с малка добавка на други елементи. По този начин, кислород е един от най-важните химически елементи. Освен това, молекулите са в голямо разнообразие на химични съединения, които се използват във всекидневния живот. За да опише всички свойства на този елемент не е достатъчно и сто страници, така че ние да ограничи основните факти, истории, както и основните елементи характеристики - Валенсия и на степента на окисление на кислород, делът на прилагане на основните физични свойства.
История на откриването на химичен елемент
Кислород - особено молекулна структура
Активен химичен елемент е безцветен газ, без мирис и вкус. Химична формула - О2. Химиците наричат обикновен двуатомен кислород или "атмосферен кислород" или "диоксид."
Валентността на кислород и степента на окисление
Под валентността на химичен елемент има предвид способността му да поеме определен брой атоми на други химични елементи. Валентността на кислород е две. Валентността на молекулата на кислород също равно на две, тъй като двата атома, свързани един с друг и имат способността да се свързва с неговата структура дори един атом на друго съединение, т.е. образуване на ковалентна връзка с него. Например, една молекула вода Н2 О което води до образуване на ковалентни връзки между един кислороден атом и два водородни атома.
Кислородът е намерена в много от познатите химични съединения. Има дори отделен вид на химически съединения - оксиди. Това вещество, получено чрез комбиниране на почти всеки химичен елемент с кислород. Степента на окисление на кислород в окиси е равен на -2. Въпреки това, в някои съединения тази фигура може да бъде различен. Повече за това ще бъдат описани по-долу.
Физични свойства на кислород
Нормално двуатомен кислород е газ, който няма цвят, мирис и вкус. В нормално състояние, неговата плътност - 1,42897 кг / м 3 Mass от 1 литър вещество е малко по-малко от 1.5 грама, т.е. чист кислород е по-тежък от въздуха. При нагряване, молекулата се дисоциират в атоми.

Когато температурата на средата се понижава до -189.2 С кислород се променя структурата си от газообразните на течността. По този начин има възпаление. Когато температурата се понижава до -218.35 ° C има промяна на структурата с течния кристал. При тази температура кислород е под формата на синкави кристали.
При стайна температура, кислород е умерено разтворим във вода - по едната му литър 31 милилитър на кислород. Разтворимост с други вещества: 220 мл за 1 литър етанол, 231 мл за 1 л ацетон.
Химичните свойства на кислород
Във връзка с алкални метали активни форми супероксиди кислородните или супероксид. Примери на такива конструкции са:
Тяхната особеност е, че степента на окисление на кислорода в супероксид е -1/2.
Във връзка с най-активната химичен елемент - флуор, получени флуориди. На тях ще бъдат обсъдени по-долу.
По-висока степен на окисление в кислородни съединения
В зависимост от това вещество взаимодейства с кислород, кислород има седем степени на окисление:
- -2 - в окиси и органични съединения.
- -1 - в пероксид.
- -1/2 - в супероксид.
- -1/3 - в неорганична озонид (вярно триатомен кислород - озон).
- +1/2 - в солите на кислород катион.
- +1 - в монофлуоридфосфат кислород.
- +2 - в кислород дифлуорид.
Както може да се види, толкова по-висока степен на окисление на кислород постига оксиди и органични съединения, и флуориди има дори положително мощност. Не всички видове взаимодействия могат да се извършват по естествен начин. За образуването на някои съединения изисква специални условия, като например високо налягане, висока температура, експозиция редки съединения, които почти не се срещат в природата. Разглеждане на основния кислород съединението с други химични елементи: оксиди, флуориди и пероксиди.
Класификация оксиди на киселинно-основни свойства
Има четири вида оксиди:
Окисляване кислород в тези видове съединения са -2.
- Основни оксиди - съединение с метали, имащи ниски окисление. Обикновено, когато взаимодейства с киселини се получава съответната сол и водата.
- Киселинни оксиди - неметални оксиди с висока степен на окисление. В допълнение към тях вода, образувана киселина.
- Неутрални оксиди - съединения, които не влизат в реакция с киселини или с основи.
- Амфотерните оксиди - съединения с метали с ниска стойност Електроотрицателност. Те са, в зависимост от обстоятелствата, проявяват свойства и киселинни и основни оксиди.
Пероксиди, степента на кислород в окисляването на водороден пероксид и други съединения
Пероксиди, наречени кислородни съединения с алкални метали. Те са получени чрез изгаряне на тези метали в кислород. Пероксиди органични съединения са изключително експлозивни. Те могат също така да бъдат получени чрез усвояване на кислород оксиди. Примери на пероксиди:
Всички те имат общо е, че те съдържат кислород група -О-О-. Следователно кислород в степента на окисление е -1 пероксиди.

Други видове пероксиди са:
- супероксиди (супероксиди, в които кислород има окислението -1/2);
- неорганични озониди (изключително нестабилни съединение с в неговия анион структура озон);
- molozonide (съединение като връзка, -О-О-О-, в нейната структура).
Флуориди, степента на окисление на кислород БЗ 2
Флуор - най-активен член на всички в момента са известни. Следователно, реакцията между кислород и флуор да не оксиди и флуориди. Те са наречени така поради това съединение не е кислород, и флуор е окислител. Флуорът не може да се получи по естествен начин. Тяхната синтезира само чрез екстрахиране връзка с флуор водна КОН на. кислородни флуориди са разделени на:
Да разгледаме по-подробно всяко от съединенията. кислород дифлуорид в неговата структура е безцветен газ със силна неприятна миризма. При охлаждане кондензира в жълтеникава течност. Течността слабо смесим с вода, но добър въздух, флуор и озон. Химичните свойства на кислород дифлуорид - много силен окислител. Степента на окисление на кислород БЗ 2 е 1, т.е. в това съединение е флуоро окислител и кислород - редуктор. БЗ 2 много токсични, повече от чист флуор и е в близост до фосген в степента на токсичност. Основната използването на този вид съединение - като окислител за пропеланта, тъй като кислород дифлуорид не е взривоопасен.
монофлуоридфосфат кислород в нормално състояние е твърд жълтеникав. При топене, образува червена течност. Той е мощен окислител, силно експлозивен в контакт с органични съединения. Това съединение показва кислород окисление равно на 2, т.е. в този Флуорид кислород съединение действа като редуциращ агент, и флуор - окислител.
Озонът и неговите съединения
Озонът - молекула, притежаваща три кислородни атома, свързани един с друг. В нормално състояние е син на газ. При охлаждане, течните форми на тъмносин цвят близо до индиго. Твърдият е от кристал с тъмно син цвят. Озонът има остра миризма, тя може естествено да се почувства във въздуха след силна буря.
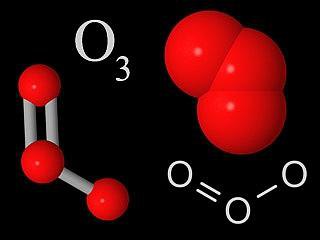
Тъй като озона е много силен окислител и почти всички процеси, свързани с участието си голямо количество O2. след това озонът е изключително токсично вещество. Въпреки това, в горната атмосфера озоновия слой играе ролята на рефлектор на ултравиолетова светлина.
Тъй озон използване лабораторни инструменти създават органични и неорганични озониди. Това е много нестабилна по отношение на структурата на материята, така че създаването им в естествени условия е невъзможно. Озониди се съхраняват само при ниски температури, тъй като при обикновена температура, те са изключително токсични и експлозив.
Използването на кислород и неговите съединения в промишлеността
Поради факта, че по едно време, учените са установили, каква степен на окисление от кислород във взаимодействието с други елементи, то и неговите съединения са широко използвани в промишлеността. Особено след средата на двадесети век са били измислени турбо разширители - елементи, способни на превръщане на кислород в механична потенциална енергия.

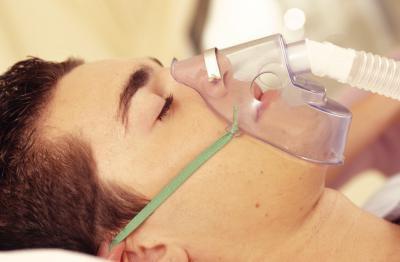
В химическата промишленост, кислород се използва като окисляващ агент в киселина въглеводородни съединения, като алкохоли, киселини и други подобни. Г. Лекарството се използва при понижено налягане при пациенти с белодробни проблеми, да поддържа живота на организма. В селското стопанство, малки дози от чист кислород се използва за отглеждане на риба в езера, за увеличаване на дела на говеда и други подобни. D.
Кислород - силен окислител, което е от съществено значение за съществуването на
Над него е много писано за това, което кислород има степен на окисление, когато влизат в реакция с различни съединения и елементи, какви кислородни съединения, има, какви видове животозастрашаващо и които не са. Един може да остане неясно - като във всички от неговата токсичност и висока степен на окисление на кислород е един от елементите, които са от съществено значение за живота на Земята? Фактът, че нашата планета е много балансирано тяло, която е пригодена специално за веществата, съдържащи се в атмосферния слой. Тя се включва в цикъла, който е както следва: човек и всички други животни консумират кислород и произвежда въглероден диоксид, и растения в по-голямата част консумират въглероден диоксид и произвеждат кислород. Всичко в света е свързана, и загубата на едно звено във веригата може да се счупи по цялата верига. Ние не трябва да забравят за него и да се грижи за живота на планетата като цяло, а не само отделни нейни представители.


10 интересни факти за интимност, за които най-вероятно не са знаели Вижте най-интересните и внушителни факти за сексуалната активност, която ще ви изненада.

Какво се случва с човешкото тяло, което не се прави секс? Секс - е почти едни и същи основни нужди, като приема на храна. Най-малкото, те започнаха да се правят, че няма да спре. Дори и да priderzhivaetes.

Свързани статии
