Енергията на активиране на елементарните р-ции, мин. енергията на реагентите (атома. сътр молекули. частици) достатъчни, за да се гарантира, че те са влезли в химически. р-ТА, т. е. за преодоляване на бариерата в превръзка-STI на потенциалната енергия, която разделя на реагентите от продукти р-нето. Потенциал бариера - максимално потенциалната енергия чрез към-ране трябва да преминат система в началното акта на химическо вещество. трансформация. Височината на потенциалната бариера за всеки път, преминаващ през състояние на преход, равен на потенциалната енергия в състояние на преход. Ако комплекс р-нето, състояща се от серийни и паралелни елементарни р-ции, има ограничаване елементарен р-ТА (р-ТА с макс. Характерно време) е енергията активиране и енергията активиране на комплекса р-нето. Макроскопичния. Chem. кинетична енергия aktivatsii- energetich. Ea опция. част от Арениус уравнение: където к - постоянна скорост; А - фактор честота (постоянна или леко в зависимост от m-тура стойност); к - е Болцман константа; Т - абе. темп. Графика LNK 1 / Кт (Арениус графика) - права линия. Наблюдаваната активиране енергия се изчислява от наклона на тази линия. Като цяло, комплекс р-ции параметър Equ Ea Арениус-SRI р-ЛИЗАЦИЯ е активиране енергията на отделните етапи и определя активиране енергия се нарича. ефективно (емпирично, очевидно).
Всеки процес, придружен НАСЛЕДСТВО промяна на енергия е екзотермична в една посока и ендотермичен в другата. енергията на активиране е екзотермична. и ендотермичен. р-ционни посоки обозначени съответно. и са свързани с:
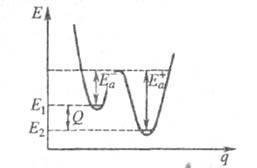
където Q - .teplota р-ТА при Т = 0. Качествен двумерен Geom. Вектор активиране на енергия поради потенциалната височина бариера и топлина р-нето е показано на фиг. където Q е координатната отговор (виж също активен комплекс теория.); Е1 и Е2 - енергийни нива съответно. основното състояние на реагентите и продуктите на р-ТА.
Р-ции Своб рекомбинация. радикали (в т. ч. и атома), а също и за широк клас екзотермична. йон-молекулни реакции, активиране на енергия е равна на нула или много малки в сравнение с типичните стойности на химическата енергия. Отношенията Дб. Р-ции, придружено едновременно разкъсване и някои други химически форма. връзки, обикновено е от няколко стотни до десети от Дб. ако между реагента е БЕЗПЛАТНО. радикали и е сравнимо с Дб. ако реагентите - химически наситен молекула. т. б. необичайно голям (напр. по-голяма атомна енергия възбуждане E *) за р-ции закалителни електронно възбуждане атома сблъсъци. A * + А + А, ако точката на пресичане на реагенти и условия на продукта р-нето е висока в сравнение с E * условия или не се пресичат.
Известен емпирични. корелация за създаване на приблизителна връзката между Ea и Q за единичен тип р-ции, например. Обикновено Полани-Semenov:
където E0 и - константа. Теоретично. Ea изчисления, направени от приблизителни методи на квантовата химия. В точния размер-последователна. докато изчисления се извършват за системи, съдържащи не повече от 3 електрони. напр. 3 за водородни атоми.
За да придаде необходимата енергия за активиране отоплителната система се използва, действието на електромагнитно излъчване и т.н., и катализатори са въведени. ръководства химикал. р-ТА път с по-ниска енергийна активация.

Свързани статии
