Химия и инженерна химия
Структурата на електронни нива на атома на тези елементи, характеризиращи се с почти пълно завършване на предпоследното ниво -podurovnya шест у желязо, седем - от кобалт и осем - от никел. Пълнене -podurovnya от атомите на тези елементи се отразява намалението на окисление. от / -podurovne съдържа минимален брой несдвоени електрони (вж. Chemistry Course. ч. 1. Общи теоретично, Ch. 11, стр. 86). Ето защо, ако броят на манган окисляване е особен дори 7. железния атом може да се прилага не повече от шест електрони и следователно неговото окисление може да не е повече от шест. Номерът на окисление на кобалт не mozheg бъде повече от пет, и -1-4 никел. По този начин. между тези атоми не могат да се разглеждат всички нива незапълнени валентните електрони. Едновременно с увеличаване на стабилността почти SR (допълва / -podurovnya намалена склонност на тези елементи да metalloobraznym съединения с електронна проводимост. [C.126]

Фиг. 20-23. Цитохром С, което е глобуларен протеин с 104 аминокиселини, свързани една верига и хем група. съдържащ желязо атом. В този схематично фигура, всяка аминокиселина е обикновено представени pronumerovan-
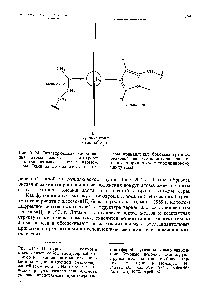
Структурата на нивата на електрони на атома на желязо, кобалт и никел, характеризиращ се с почти пълно завършване на предпоследния -podurovnya електронен ниво шест електрони - желязото, седем и осем в кобалт - никел имат. Пълнене -podurovnya от атомите на тези елементи се отразява намалението на окисление. тъй -podurovne съдържа минимален брой несвоен електрони. Следователно, дори ако характеристиката на манган окислително число 4-7, железния атом може да се прилага не повече от шест електрони и следователно степента на окисление, може да не бъде повече от 4.6. Номерът на окисление на кобалт не може да бъде повече от 4-5, и 4-4 никел, по този начин. електрони не може да се приеме, че всички слоеве на незаети валентността на атомите на тези елементи. Едновременно с увеличаване на стабилността почти пълни -podurovnya намалена склонност на тези клетки до образуването на метални съединения с електронна проводимост. Електрическа проводимост на този вид има само silidy тези метали. [C.297]
Подобна хибридизация възниква и преходни елементи. В този комбиниран с 3D, 4S- и 4 / орбити. От особен интерес е S / й г-хибридизация. Полинг показа, че въпреки че има шест еквивалентни електронни вериги, насочени, например, заедно положителните и отрицателните посоки на оси X, Y, Z (осмостенно хибридизация) на. Те участват хибридизация да обясни структурата на комплексните съединения на Fe йони (N) и типа или Co (YNz) б. железен атом има външни електрони (3df (4s). Ion Fe + има структура (3d) "(4s) е енергично благоприятно три възбуди електрон от състояние на състоянието W 4P. След извършва състояние (MU (4s) в последвалата йон ( прекарано фа вълнение 4P). Две / електрон, един 4s и три 4P дават осмостенно хибридизация. Получената в шест здрави връзки. компенсиране на енергия. [c.480]
Понякога малки промени в околната среда може да доведе до сериозни промени във формата на протеин. които оказват влияние върху неговата функция. Например, леко увеличение на рН промени молекула хемоглобина в кръвта, така че да става в състояние да премине към вътрешната повърхност на белите дробове и се отваря в молекулата атом желязо. в резултат на лесно свързва кислорода. Чрез понижаване на гънките на рН верига обратно, което помага да се подчертае кислород след трансфер в клетката, където това е необходимо. [C.455]
При контакт с електролита, металните атоми в съоръженията на повърхност (газопровода) са изложени на силовото поле на водните молекули. които могат да бъдат въведени в структурата на метална решетка. ефект група може да бъде толкова силна, че прекъснатата връзката между металните атоми в кристалната решетка. Torn така метални атоми структури, които се движат в електролита, образуващи йон-атом, носещ заряд. Около йон атом ориентирани водните молекули, представляващи диполи. железен атом движи в електролит с положителен заряд. и строителството е отрицателно заредена. Така че има двойна електрически слой. където хидратирани ферийони под въздействието на електрически сили, взаимодействащи с отрицателните заряди на структури на повърхността се запазват конструкции ЛИЗАЦИЯ. Може да дойде време, когато под влияние на електрическа енергия в електрическа двоен слой на равновесие и по-нататъшното преминаване на атомите на стомана в спира електролит. [С.6]
Колко грама алуминиев понижено железен оксид а) 5.6 грама на желязо б) 4 грама-атом на желязо [c.102]
Предвиждането валентност. Ако започнем от предположението, че валентността на един атом е равен на броя на електроните несвоен в своята външна обвивка. благородните газове атоми не следва да дава съединения с други атоми, като в основното състояние завъртания на всички електрони са сдвоени. Междувременно открити и изследвани съединения на благородните газове халоген и кислород като убождане. XEO 4, Xe 2 и др. По-трудно да се обясни съществуването на така наречените сандвич съединения. като фероцен, където железен атом е свързан с две циклични молекули Vos. (Фиг. 17). Той би трябвало да образува връзка с десет въглеродни атома, които нямат десет електрони във външната обвивка на електрони. [C.57]
Какво е съотношението (в проценти) на хром и желязо в ферохром, в която за всеки три хром атоми имат един железен атом [c.162]
Според уравнения (1) и (2) една грам-атом на желязо взаимодейства с 1,5 мола хлор и една грам-атом на мед - с един мол от хлор. В този случай, количеството на хлор. взаимодейства с Fe и Cu може да се изрази със следната формула [c.450]
Изчисляване на теглото на железни атоми в грамове. 1гр-атом на желязо заоблени тежи 55,85 брой атоми в размер, равен на 6-10. Теглото на железен атом, 1 = 55.85 г = 6-10 9,3-г. Тези проблеми могат да бъдат решени и по следния начин [С.7]
Хидрогениране на въглероден монооксид за получаване на по-високи въглеводороди и алкохоли Gj е сравнително бавно каталитична реакция. Anderson [27в] Изчислено е, че молекулата на въглероден окис живее на повърхността на катализатор кобалт за около 5 минути. преди тя да реагира. Всички активни синтез катализатори sodern атомен желязо, iikel, кобалт или рутений като основен компонент хидрогениране. Тези четири метал при условията на синтез бавно, но измерим скоростта да образуват метални карбонили, които очевидно има определена стойност. Оптималната температура за синтез на никел и кобалт в диапазона 170-205 °, 200-325 ° за желязо и рутений 160-225 °. Допустимо максимално налягане за синтеза на никелови катализатори в количества от около 1 атм да кобалт - 20 в. При по-високи налягания активността на тези катализатори силно намалява (като повишаване на налягането). Железни катализатори. се получава чрез стапяне магнетит проявяват активност при налягане 20-100 атмосфери I, а утаените железни катализатори над 20 в отслабена I27d]. Рутений катализатори са относително неактивни при налягане под 100 атм, но тяхната активност се увеличава бързо му увеличение до 300 атм [27д]. При оптимални натиск (O-1 атом на Ni 1-20 атм за движение, 1-20 атм за Fe-утаяват катализатори 20-100 банкомат преработени Fe-катализатори и 100-300 атм на Lu) от съотношението на налягане (компонент е в скорост уравнение, което х = koistat налягане ") е около 0-0.5 и за Ni и Go е близо до единство на Fe и Ru. [c.521]
Оксиди и gioroksidy. Желязото реагира с кислорода след -ische прост oksndy FeO и ReoOo ReOz оксид FeO е основен характер. RegOz-амфотерен ReOz - киселина. Първите две oksnda способни комбиниране за образуване на кисел oksnd Rsz04 където един железен атом е в окисляване eteneni на 2, а другите две - на степента на окисление на -Z. [C.302]
Вместо това, продуктът се изолира оранжева реакционна. по който молекулата е включена и железния атом в САЩ В същото време група от химици е получил точно една и съща връзка. Те решиха, че това вещество - бис tsiklopentadienilzheleza. [C.218]

От голямо значение е желязо комплексирането с bioligands [2, стр. 165-184]. Особено важно е хемоглобин на - желязо-съдържащ протеин молекула. извършване в кръвта на животни и хора функция кислороден носител. Хемоглобинът съдържа глобиновия белтък и четири хема. представлява порфирин железен комплекс (II), където железен атом образува връзка с четири азотни атоми на порфириновия пръстен, и една връзка към азотния атом gistidina- аминокиселина, част от b1elka глобин. Шесто място в координация областта на желязо (II) може да бъде заета с молекулен кислород O2 и CO-тип лиганди, CN и др. Ако влезе хемоглобин взаимодейства, например с СО, то губи способността си да обратимо придават O2. В този случай организмът е убит от хипоксия. Това обяснява високата токсичност на СО, SC - и подобни лиганди. [C.134]
Как оксид концентрат желязо Fe P4 образуват шест грам-атом на желязо REC sgoranip пълен отговор на въздух изразено в молове и грама. [C.107]
VII.4, където точките 2 и 3, например, съответстват на степента на окисляване на Fe (II) и Fe (III). В Na2 комплекс [Fe (N) 5NO], показано на фиг точка 4, в зависимост от това дали заряд приписва на нитрозо N0 положително, нула (неутрална група) или отрицателен железен атом може да има степен на окисление (II), (III ) или (IV). Въз основа на химическа смяна e2rz / 2 (711.0 ЕГ до 710,0 ЕГ разлика за Ks [Fe (CN) е], и 708.7 до К4 [Fe (CN) Ь]), степента на окисление на желязо в комплекса е ( IV). Това навежда на извода, че обвинението нитрозо отрицателна. [C.159]
Имайте предвид факторът 2, който се появи на втория ред. Съгласно формула FeSj един железен атом пада до 2 серни атоми, обаче, системата може да бъде пренаписана под формата на Fe 2-le- = Fe 1 [c.97]
Голям клас комплекси са комплекси Вичев пясък, който е предшественик на фероцен, Фероцен е жълто-оранжеви кристали на органометално съединение, в което се намира железен атом между две силно симетрични пет-членни пръстени. образува въглеродни атоми (виж схема 13.7). [C.369]
Съобщение в фероцен може да се разглежда от гледна точка на опростен метод на молекулните орбитали [80]. Всяка циклопента-диенил пръстен има пет три молекулно орбиталните пълни свързване орбитали и antibonding орбитали на две свободни (Sec. 2.9). Външната електрони обвивка на железен атом се състои от девет атомна орбитала един 45, три и пет 4R- Sc (г орбитали. Шест заети орбитали на две циклопентадиенилови пръстени се припокриват един с Z-, три и две р орбитали на железния атом, като дванадесет нови орбитали , шест от които са задължителни и форма две тройни връзки пръстен метал. Допълнителна свързване е в резултат на припокриване на свободни antibonding орбитали пръстени с другите населените желязо орбитите. Следователно. девет орбитали Rep 18 се намира електрони (който може да се разглежда като 10 електрони дават два пръстена, и 8 -. Железен атом в състояние на нула окисляване) шест орбитален - силно свързване, и три -. Слабо свързване или необвързваща [c.72]
А. Получаване на Морова сол (NH4) 2504 Re304-6N20. Изчисляване на размера на 25% сярна киселина. необходимо за разтваряне на 0.5 грама на желязо и 1.5 приемане кратен излишък. Желязо на прах за посипване тръба Кор сярна киселина и се загрява внимателно. Когато металът разтваря. и филтриране на разтвора в блюдо uparte порцеланова преди образуването на кристалния кора на повърхността. Приготвя гореща наситен разтвор на амониев сулфат от изчислението на 1 атом на железен сулфат представляват молекула am.mo-ТА. Получените разтвори се смесват горещо и се оставя да кристализира при 0 ° С Кристалите се отделят от течността и суха филтърна хартия. Претеглят сол и се изчислява добивът в процента на желязото взети. [C.398]
Утайката се филтрува, промива се със студена вода и се суши при 40-50 ° С Geksabeizo-атом на желязо (III) -вещество кремък цвят, стабилна във въздуха, неразтворим във вода, разтворим в ацетон, от които може да perekristallnzovat [c.264 ]
Фероцен първата металоценови синтезиран през 1951 г. Джорджия (Kim и Pawson) е sandvicheobraznoe структура - между две паралелни циклопентадиенил пръстенен атом е желязо и молекулата има център на симетрия (XVI). След това, други металоцени тип XVI, в която са получени железния атом се замества с Ti атома, V, Cr, Mn, Co, N1, Ri, Оз, Mg. [C.307]
Ако броят на железни атоми е по-голямо от единица. образува клъстер (клъстер), в която, както се оставя има една електронна връзка между железните атоми. В клъстер съдържа не само хи-Stein и лабилен сяра и може да се освободи NLI един електрон. тип-5 1Re протеин, т.е. Той съдържа един железен атом, а именно rubredoksin са добре проучени чрез различни методи. В резултат на това е доказано, че само железен атом в молекулата на протеин е заобиколен от четири цистеинови остатъци, разположени във върховете на тетраедъра. И двете (окислява и редуцира) състояние на комплекса - високо завъртане. Тези протеини имат молекулно тегло от около 6000 и могат да предават Фиг 1U5 структура (за молекула) на един електрон. [C.366]
Виж страница, когато срокът е посочен железния атом. [C.219] [c.121] [c.192] [c.367] [c.219] [С. 16] [С. 15] [c.150] Произведения на научно-популярна, исторически, критичен и библиографска и други работи по химия том 3 (1958) - [c.229]
Свързани статии
