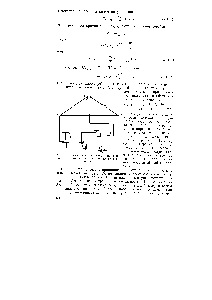
Фиг. 29. Схема на инсталацията за измерване на напр. г. а. галванични клетки
Стандартни потенциали дават представа за възможната насока на окислително-редукционни химични реакции. Въпреки това, в реални условия, тази област може да бъде различна, поради следните причини. Редоксисистемите. в зависимост от скоростта на реакцията. ще се проведе на електродите са разделени на обратими и необратими. Стандартни потенциали обратими системи измерва директно по начина, описан по-горе, а стандартните потенциала на необратими системи в повечето случаи се установява от термодинамични изчисления. Поради тази практика на техните стойности са различни, тъй като те имат по-голям ефект от много фактори. Така например, системи за необратима промяна се наблюдава закон за изграждане в съответствие с концентрацията на компоненти. и изчисления се извършват като се използват стандартни окислителни потенциали и концентрациите на компонентите. са по-илюстративно, отколкото да отговарят на актуалните данни. Ето защо, много по-голяма практическа значимост са формални (истински) потенциали на окислително-редукционни системи. Формални потенциали (е) са измерване напр. г. а. клетка. където първоначалната концентрация на окисляващи компоненти [c.350]
Уравнение (С.5) позволява използването на електронна. г. а. клетката за проучвания на термодинамични процеси. се провежда в електродите. Сложността на тези изследвания е, че за директно свързване към електрохимична клетка на конвенционален измервателен уред (волтметър) термодинамично равновесие в системата е счупен. Доказано е вече, води до нарушаване на резултатите, тъй като те не се измерва д. г. а. елемент Е, и разликата на електростатичен потенциал и електроди iyam. По време на измерванията в съответствие с всички правила за справяне с използваните измервателни уреди. Измерва се температурата на разтворите. [C.165]
източник на постоянен ток (вж. фиг. 28) трябва да включва прекъсвач P, а след това и ключ K включва нормалната клетка или електрохимична клетка. д. г. а. която се измерва. Изключете в обратен ред. Ако измерването на д. г. а. всеки потенциометър плащане онлайн, проверете правилното сглобяване на измервателния уред, съгласно схема (вж. фиг. 28), включително полюса на елемента за изпитване и източника на ток. както и контакти. Колебанията в паралелни измервания показват лош контакт в главната верига (ток източник верига). При липса на ток в контактите странични вериги и тества всички проводници състояние. Не може да има стъкло в тънки секции за контакт и мост електролит са въздушни мехурчета. Терминали за електродите на плочите не трябва да докосват решения. Необходимо е редовно да проверяват захранващото напрежение и да извършва калибриране на потенциометъра. Свържете разследван електрохимична клетка и нормален елемент от ключово значение за потенциометъра трябва да бъде само върху измерване Е. г. а. и в много кратки интервали от време, за да се избегне поляризация явления и промени в концентрацията на йони в разтвори се дължи на работата елемента. За umenshetsiya йонна дифузия от половината клетка към друга са свързани чрез електролиза мост точно преди измерване напр. г. а. Мостове, съхранявани в солен разтвор. Електродите и електрохимични клетки се събират в стъклени съдове. форми на които са описани в документите. [C.142]
Електрохимични клетки от този тип се наричат мошеници tsentratsionnymi елементи. В действителност, тези елементи не се използват за производство на ток. но от гледна точка на теорията и методите за измерване на, те са от някакъв интерес. Така например, на базата на електронна. г с., като елемент може да се определи неизвестната концентрация на йони. [C.165]
Фиг. 129 показва измерване верига irintsipialnaya напр. г. а. клетка. В компенсиране верига включва текущата източник NZ - батерията 1, напрежението, което се подава към slidewire AB, 2 галванометър чувствителен елемент 10 и тест елемент Уестън нереките nochatelya 4 5 6 прекъсвач и подвижния контакт С. Методът се основава па че измерва напр. г. а. uravnoveschivaetsya (компенсиран) д. г. а. батерия. [C.298]
Вижте страниците в които се споменава терминът Галванична клетка за измерване на член рН. [C.268] [c.424] [c.195] [c.126] [c.138] [c.309] [c.304] Определяне на рН теория и практика (1968) - [c.0]
Свързани статии
