Разнообразие от химически връзки
Външната обвивка на всички елементи с изключение на благородни газове е непълна и в процес на химическо взаимодействие между тях се прекратява.
химичната връзка, образувана от външната електрони обвивка на електрони, но това се извършва по различен начин.
Има три основни вида химични връзки:
- ковалентна връзка и неговите варианти: полярен и неполярен ковалентна връзка;
Йонната химичната връзка - връзка, образувана чрез електростатично привличане на катиони на аниони.
Йонна връзка възниква между въглеродните атоми, рязко различаващи се един от друг стойности електроотрицателност, така че двойка електрони образуващ връзка силно пристрастен към един от атомите, така че може да се счита, принадлежащи към атом на елемента.
Електроотрицателност - способността да се атоми на химични елементи да се привлекат свои собствени и тези на другите електрони.
Йонийски свързване характер, структура и свойства на йонни съединения, за да обясни позиция електростатичен теория на химически връзки.
Например: 2Na + Cl2 0 0 = 2Na + Cl -
При изгаряне на метален натрий в хлора резултат на окислителната реакция, образуван -vosstanovitelnoy натриеви катиони силно електроположителна елемент и аниони силно електроотрицателна хлор елемент.
Заключение: йонен химична връзка е образувана между метални и неметални атоми, значително се различават по електроотрицателност.
Ковалентното свързване на атомите се нарича чрез общото (разделен между двете двойки електрони).
Разгледа настъпването на ковалентна връзка с неполярен пример образуването на водородни молекули на два водородни атома. Този процес има типичен химична реакция, поради едно вещество (атомен водород) образува друга - молекулярна водород. Външно енергия знак "полза" на този процес е изолацията на голямо количество топлина.
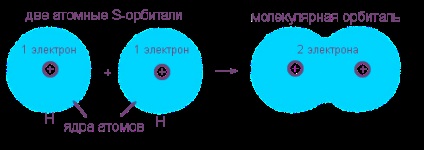
Електронен корпус от водородните атоми (един S-електрон всеки атом) слят с общо електронен облак (молекулно орбитален) когато двете електрон "услуга" ядрото дали "я" е основна или "чужд". Ново пълно електронна обвивка подобен електрони обвивка на инертен газ хелий на от два електрона: 1s 2.
На практика се използват по-прости начини. Например, американският химик Джон. Луис през 1916 г., предложен електрони етикетиране
до символите на елементи. Една точка показва един единствен електрон. В този случай, образуването на водородни молекули от атомите изписва така:
Разглеждане на свързване на два хлорни атоми 17 Cl (ядрен заряд Z = 17) в двуатомен молекула от гледна точка на структурата на електронен слой на хлор.
На външен електронен ниво хлор, съдържаща 2 а + р = 5 7 електрони. Тъй като по-ниски нива на електроните не участват в химична реакция от само електроните точки означават
трето ниво. Тези външни електрони (седем броя) могат да бъдат подредени във формата на три двойки електрони и един несдвоен електрон.
След комбиниране в молекулата на несдвоени електрони на двата атома, получени чрез нов електронен чифт:
По този начин, всяка от хлорни атоми е заобиколен
електрони. Това се вижда лесно, ако някоя кръг на хлорни атоми.
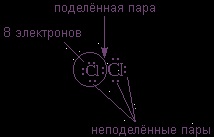
Ковалентни форми облигации само двойка електрони, разположен между атомите. той се нарича
Останалите двойки електрони, наречени
Те изпълват корпуса и не участва в свързването.
Атоми образуват химична връзка от социализация количество от електрони, за да придобие електронна конфигурация подобна на завършване електронна конфигурация на атомите на благородни елементи.
Според теорията на Lewis и правило октет връзка между атоми може да се проведе не е задължително еднакви, но
настръхнали двойки, ако е необходимо чрез правилото за октет. Тези връзки се наричат
двойни и тройни.
могат да образуват двуатомен молекула с октет на електрони всеки атом само когато атоми са поставени между разделените двете двойки:
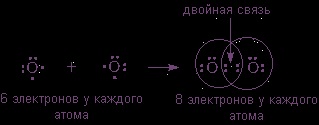
(2s 3 2p 2 в последната обвивка) също се свързва с молекула, молекула, но за организация октет на електрони е необходимо да ги позиционира между двойка три разделена:
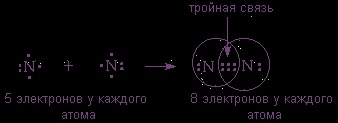
Заключение: възниква неполярен ковалентна връзка между атомите в същото електроотрицателност, т.е. между атоми на химичен елемент - неметални ...
Например: в молекулите на Н2 Cl2 N2 P4 Br2 - неполярен ковалентна връзка.
Полярен ковалентна връзка
Той заема междинно положение между чисто ковалентна връзка и йонна връзка. Както и йон, тя може да се случи само между два различни вида атома.
Като пример, помисли за образуването на вода в реакцията между атомите водородните (Z = 1) и кислород (Z = 8). Той е удобен за записване на първите електронни формули за външни черупки водород (1 1) и кислород (. 2s 2 2p 4).
Оказва се, че за това е необходимо да се вземат два водородни атома на един кислороден атом. Въпреки това, природата е такава, че акцепторни свойства на кислород е по-висока от тази на водородния атом (причините за това - малко по-късно). Следователно свързващи електронни двойки във формулата за водата Lewis леко изместен към ядро кислороден атом. Bond в молекулата на вода - полярен ковалентна и от атоми появи частични положителни и отрицателни заряди.
Заключение: полярен ковалентна връзка възниква между атомите с различна Електроотрицателност, т.е. между атоми на различни химични елементи - неметали ...
- полярен ковалентна връзка.
Сега се приема да представляват електронни двойки (т.е. химическите връзки между атомите)
Всеки тире - е разделен от двойка електрони. В този случай, ние вече сме запознати молекули изглеждат така:
Формула с тире между атомите се наричат структурни формули.
Най-често в структурните формули не представляват самотни двойки електрони
Структурните формули са много добри за образа на молекули: те показват ясно - атомите, свързани заедно в какъв ред, което връзки.
Свързването на електронна двойка на формули Lewis - същото като един пробив в структурните формули.
Двойни и тройни връзки имат общо име -
За азот молекула също така казват, че тя има
равно на три. Редът на кислород молекула връзка е две. Процедура на водород и хлор молекули - един. В водород и хлор вече не е кратно и проста връзка.
Bond - да е броят на двойките социализираното разделен между двете свързани атоми. Редът на връзките по-горе три не е намерен.
Свързани статии
