Химично свързване е силата държи заедно два или повече атоми, йони, молекули или всяка комбинация от тях. По своята същност това е електростатично сила на привличане между отрицателно заредените електрони и положително заредени ядра. Големината на тази атрактивна сила зависи главно от външна обвивка електрон конфигурацията на атомите (вж. Ch. 1). Например, благородни газове са трудно да се образува химически връзки, защото те имат стабилен външен електронен корпус. В контраст елементи, чиито атоми са в външната обвивка само един електрон, лесно образуват връзка. Пример за такъв елемент е водород.
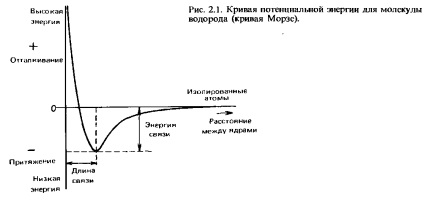
Когато два водородни атома се приближават един към друг с малко разстояние, те са привлечени един към друг. Въпреки това, ако те подхождат твърде много, има отблъскване между тях. Оптималната е разстоянието, на което привличане и отблъскване сили са балансирани. Това разстояние Ха потенциална енергия минимум две взаимодействащи атома. Това разстояние се нарича дължина на облигации. Ние ще се върне към своя по-подробна дискусия в тази глава. Ha Фиг. 2.1 показва зависимостта на потенциалната енергия на разстоянието между ядрата. Кривата на този вид се нарича Morse крива. Необходимата за разделяне на две свързани атоми, и да ги отстрани един от друг на разстояние, на което те вече не се чувствам силата на привличане помежду си енергия се нарича свързващата енергия, или енергията на дисоциацията на комуникация. Нейната експериментално определяне се извършва чрез измерване на енталпията връзка (с този термин се срещаме в Chap. 5).
Способността атом образуват химически облигации, наречени своята валентност. Въпреки това, тази концепция се счита за остаряла, тъй като има в момента е много по-често се смята за химична връзка не е по принцип, но като се вземе предвид специфичната му вид. Електроните prshshmayuschie участва в образуването на химичните връзки, се наричат валентност електрони. Тези електрони са най-високите енергийни орбитите на атома (вж. Ch. 1). Външната обвивка на атом, който съдържа тези орбитали се нарича черупката валентност.
Електронна теория valentnosti.Sovremennye представа за характера на химичната връзка въз основа на теорията на валентните. Тази теория е разработен независимо G. Н. Lewis и B. Kossel през 1916 г., като на валентните електрони теория атоми, образуващи връзка близо до постигане на най-стабилната (т.е., с най-ниска енергия) електрон конфигурация. Атомите могат да постигнат това по два начина:
1. Те могат да запишете или да привлича електрони, за да се образуват йони. Ако атома придобиват електрони, те се превръщат в аниони. Ако те губят електрони, а след това се превръща в катиони. Аниони и катиони с попълнено външната електрон черупки имат стабилна електронен конфигурация. Между анион и катион възниква химична връзка, която е електростатични сили на привличане. Химичната връзка от типа, наричан преди electrovalent връзка; днешното име на йонна връзка.
2. Атомите могат също така да придобият стабилни външни електронни конфигурации чрез споделяне на електрони. Това се случва, когато химичната връзка се нарича ковалентна връзка. Връзката на ковалентна образуван от двойки електрони, доставени от един на всеки атом. Въпреки това, в някои многоатомни йони, молекули или две такива електрони могат да се доставят само от един атом. Този вид ковалентна връзка се нарича координация, донор-акцептор, или сменяем ковалентна връзка.
Октет правило. Когато атом на всеки елемент образува химическа връзка, получаване, загуба, или общуване валентните електрони, неговата електронна конфигурация става същата като тази на благороден газ атом, разположен в края на същия период като активен елемент, или в края на предишния период. Атомите на благороден газ с изключение на хелий, са в устойчиви октет външна обвивка (осем) на електрони. Следователно, образуването на химически връзки чрез постигане на стабилна електронна конфигурация като в атомите на благородни газове, е в основата на т.нар октет правило. Това правило се прилага за йонни, и ковалентни връзки.
Други видове химични връзки. Специален случай е химична връзка в метали; не може да се дължи на йонен тип или ковалентна връзка. В твърдо състояние метали се състои от положително заредени йони, плътно опаковани в кристалната решетка и държани заедно от свободни електрони, които "плаващо" около йони в "електронен морето." Този тип връзка се нарича метална връзка.
Има повече два вида химични връзки, които също ще бъдат разглеждани в тази глава. Това е - водород свързване и ван дер Ваалс сили. Връзката между тези два вида е значително по-слаба в сравнение с други видове комуникация.
Свързани статии
