хидролиза на неправилно аминоацил аденилат. Поради наличието на активното място на тези ензими коригиращи механизъм за гарантиране незабавно отстраняване на неправилно долепени аминокиселинен остатък се постига забележително висока точност: за 1300 свързани с тРНК аминокиселините са намерени само една грешка.
Амино киселина, свързваща тРНК не допълнително определя специфичните свойства на аа-тРНК, като нейната структура не разпознава нито рибозомно или тРНК. Участва в синтеза на протеини зависи само от структурата на тРНК, или по-скоро на антикодон комплементарна взаимодействие аминоацил-тРНК с тРНК кодон.
В антикодон разположен в централната (антикодон) линия на тРНК. TRNATyr, разпознаване аа-тРНК синтетаза не винаги се случват на антикодона връзка. Активното място на някои ензими разкрива безплатна съответствие с други части на пространствената структура на тРНК.
Рибозомите са рибонуклеопротеинови образование - един вид "фабрика", в които има натрупване аминокиселини в протеини. Еукариотните рибозоми имат утаяване постоянна на 80-те и са съставени от 40S (малки) и 60-те (големи), подотдели. Всяка субединица на рРНК и включва протеини. субединица 40S е включена в рРНК 18S и утаяване константа от около 30-40 протеини. субединица 60S рРНК на видовете намерени 3: 5S, 5,8S и 28S и около 50 различни протеини.
Протеините са част от рибозомата субединици в количество от едно копие и изпълняват структурна функция гарантира взаимодействие между иРНК и тРНК, свързана с аминокиселина или пептид.
В присъствието на иРНК 40-те и 60S субединици, образуват цялото рибозома, масата на което е около 650 пъти масата на молекулата на хемоглобина.
Рибозомата има две връзки към центъра на тРНК молекули: на аминоацил (А) и пептидил (Р) центрове, които са включени в образуването на двете субединици. В точки А и F включва иРНК част на 2-кодон. По време на предаването центъра на сътрудник аа-тРНК, който определя структурата на кодон се намира в центъра. В структурата на този кодон се кодира естествено срещащи се аминокиселини, за да се включи в нарастващата полипептидна верига. Център P заема пептидилен-тРНК, т.е. тРНК, свързани с вече синтезирани пептидната верига.
В еукариотни рибозоми разграничи тип 2 "свободен" намерени в цитоплазмата на клетките, и свързани с ендоплазмения ретикулум (ER). Рибозомите асоцииране с ER да бъдат отговорни за синтеза на протеини "износ", които са разположени в кръвната плазма и протеини, участващи в актуализиране на ER; aapparata Golgi мембрани, митохондрии и лизозоми.
Митохондриите съдържат свой собствен набор от рибозомите. Митохондриални рибозоми са по-малки от рибозомите на еукариотите прокариоти и имат постоянен утаяване на 55S. Те също така се състои от две субединици, но се различават от eukaririoticheskih рибозомна РНК количество и състав и протеини.
белтъчни фактори
На всеки етап от синтеза на протеини в рибозомите: иницииране, удължаване и прекратяване игра на различен набор vneribosomnyh белтъчни фактори. Тези протеини се свързват с рибозомата или неговите субединици, в определени етапи на процеса и стабилизират или улесняване на функционирането на машината на протеин-синтезиране.
ATP и GTP като източник на енергия
На включване на една аминокиселина в нарастваща клетка полипептидна верига изразходва енергия връзка 4 2 на АТР в реакцията, катализирана от аа-тРНК синтетаза (АТФ по време на активиране на аминокиселини се разцепва до AMP и пирофосфат) и 2 GTP молекула: един използва за свързване аа тРНК в центъра на рибозомата, а втората стъпка се изразходва за преместване. По този | трябва да се добави използването на два други високо енергийни връзки на молекули: АТР и GTP на започване и прекратяване на синтез на полипептидната верига.
Етапи на синтеза на полипептидната верига
Протеиновият синтез е цикличен летливи многоетапен процес, в който свободните аминокиселини се полимеризира в генетично детерминирана последователност за получаване на полипептиди. протеиновия синтез система, или по-точно предаване система, която използва генетична информация транскрибирана в тРНК за синтез на полипептидна верига с определена първична структура, включва около 200 вида макромолекули - протеини и нуклеинови киселини. Сред тях, около 100 на макромолекулите, включени в активирането на аминокиселини и ги прехвърля на рибозомите, повече от 60 на макромолекулите, които съставляват 70 или 80S рибозомите, 10S и около макромолекули, директно включени в системата за превод. Без обсъждане естеството на синтеза на други важни фактори считаме подробно механизма на синтеза на отделните пътища на протеиновата молекула в изкуствен системата за синтезиране. На първо място, като се използва изотопен метод е установено, че протеиновата синтеза започва с N-края и С-крайни краища, т.е. процесът се извършва в посока. NH2®COOH.
Синтеза на протеини, или процес превод може да бъде условно разделя на две фази: активиране на аминокиселини и действителния процес на транслация.
Вторият етап на матрица синтеза на протеин, всъщност излъчва, протичащ в рибозомата, условно е разделен на три етапа: иницииране, удължаване и прекратяване.
активиране на аминокиселини
Предпоставка за синтеза на протеини, които в крайна сметка се редуцира до полимеризация на аминокиселина е наличието в системата не е свободен, и така наречените активираните аминокиселини, притежаващи вътрешната си доставка на енергия. Активирането на остатък свободна амино киселина се извършва с помощта на специфични ензими -tRNK аминоацил синтетази в присъствието на АТР. Този процес се осъществява на два етапа:
И двата етапа са катализирани от същия ензим. В първия етап на амино киселина взаимодейства с АТР и пирофосфат, и образува междинен продукт, който във втория етап взаимодейства с съответната 3-тРНК ¢ -ОН, чрез което се образува аминоацил AMP -tRNK и разреди. Аминоацил-тРНК има необходимата доставка на енергия.
Амино киселина е прикрепена към терминал 3 ¢ -ОН хидроксил-AMP, която заедно с два остатъка представлява CMF терминал CCA триплет е един и същ за всички транспортни РНК.
процеса на превод
Превод започване е събитие, в която има Образование комплекс, съдържащ Met-tRNKimet, тРНК и рибозоми някъде tRNKimet иницииращ метионинов tRNKV Този процес включва най-малко 10 иницииращи фактори, които са посочени като Elf (от английски език. Еукариотните фактори иницииране) с посочване на цифри и букви. Първоначално субединица 40S на рибозомата свързва започване фактор, който го предпазва от свързване към субединица 60S, но стимулира асоциация с троен комплекс, включително Met-tRNKimet, EIF-2 и GTP. След това сега е все по-сложни свързва с тРНК 5'-края на участието на няколко Elf. Един от факторите, инициация (Elf-4F) открива и се присъединява към раздел "капачката" на молекулата на иРНК, така че е кръстен kepsvyazyvayuschego протеин. Когато свързан към иРНК, 40S субединицата започва да се плъзга по протежение на некодиращата част на тРНК, докато докато достигне началото кодон август кодиращата нуклеотидна последователност. Подхлъзване 40S субединицата иРНК се придружава от хидролиза на АТР, енергия се изразходват за преодоляване на порции спираловидно в нетранслираната част на тРНК. В еукариотни иРНК Klek некодиращи участъци са с различна дължина, но обикновено е от 40 до 80 нуклеотиди, въпреки че има зони с дължина над 700 нуклеотиди.
При достигане на началото на последователността, кодираща иРНК, 40S субединица спира и се свързва с други фактори за иницииране, ускоряване придържане 60S субединицата на 80S рибозоми и образуването поради хидролиза на GTP към БВП и неорганичен фосфат. В тази форма на А- и р-точки на рибозомата, и по F-център е кодон Aug-иРНК с прилежаща към него Met-tRNKimet.
В клетките има две различни по структура на тРНК признаване кодон август Иницииращ кодон научава tRNKimet и триплети на иРНК, кодираща включване метионин във вътрешните части на протеина, се четат друг tRNKimet
След завършване на започване на иРНК рибозом разположен така, че центърът е започване на P-Aug кодон с прикрепения към него Met-tRNKimet. и А-център - триплета, кодиращ първата аминокиселина включване синтезиран протеин. Следваща започва дългата фаза на протеиновия синтез - удължение, през който рибозома чрез аа-тРНК последователно "гласи" иРНК след нуклеотидни триплети, които следват кодон започване в 5 'към Z'-края, увеличаване на полипептидна верига поради последователното аминокиселинен допълнение.
Включването на всяка аминокиселина в протеин се появи в три етапа, от които:
• аа-тРНК на всеки член на амино киселинен протеин се свързва към центъра на рибозомата;
• пептида от пептидил-тРНК в P-разположен център присъединява към-NH2-GRUPPE аминоацил остатък аа-тРНК-център за образуване на нова пептидна връзка;
• удължен с един аминокиселинен остатък на пептидил-тРНК от А се премества в центъра на F-център Получената транслокация на рибозомата.
Свързването на аминоацил-тРНК към А-център. МРНК кодон, намиращ се в A-център в близост до стартовия кодон, определя характера на аа -tRNKaa ¢ ¢, която ще бъде включена в А-център. аа ¢ ¢ -tRNKaa взаимодейства с рибозомата в тройния комплекс, съставен от фактор EF-1 удължение, аа -tRNKaa ¢ ¢ и GTP комплекс взаимодейства с рибозомата ефективно само ако антикодон аа -tRNKaa на ¢ ¢, komplimentaren и антипаралелен иРНК кодон в А-център. Включване аа -tRNKaa ¢ ¢, рибозом се дължи на енергията на хидролиза на GTP към БВП и неорганичен фосфат
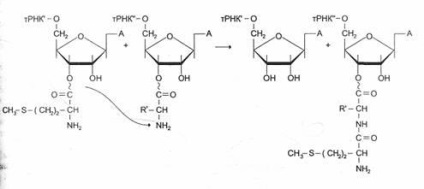
образуване на пептидна връзка става веднага след разцепване EF-1 комплекс, и GDF от рибозомата. Този етап се нарича транспептидация реакция.
По време на тази реакция, метионин остатък аа -tRNKaa на ¢ ¢, се свързва с а-амино група на първата аминокиселина прикрепен към Trnka ¢ и в pacpolozhennoy се образува първият A-център пептидна връзка. Установено е, че peptidiltrans | feraznaya дейност на рРНК голям субединицата на рибозомите 28S принадлежи. До сега открихме група на РНК като свойствата на ензими. Това каталитично активен РНК се наричат рибозоми Смята се, че рибозоми може да се считат за "реликви" на ранния период на революцията, когато протеините все още не са придобили такава важност, както и в следващи периоди.
Translocation - третия етап на удължение. Чрез рибозомата присъединява удължение фактор EF-2 и поради енергията на GTP насърчава рибозом на иРНК от един кодон на Z'-края. В резултат на това дипептидил-тРНК, която не променя позицията си по отношение на иРНК на A-център се премества на R-центъра. Безплатна метионин Трънка ¢, напуска рибозомата, а на следващия кодон е в диапазона на А-центъра.
След завършване на третия етап в центъра на удължение рибозом P има дипептидил-тРНК, и център пропуска триплет кодиране за вграждане в полипептидна верига на втората аминокиселина. Тя започва на следващия цикъл на етапа на удължение, по време на който рибозомата отново да премине по-горе събития. Повтарянето на тези цикли на броя на сенс иРНК кодони завършва целия етап удължението.
прекратяване се превод, в случай, когато един от центровете на рибозомата стане един от спирачните кодони: UAG, ИЗП, или UGA. За стоп кодони не са съответните тРНК. Вместо рибозома, да се присъединят към две протеинови освобождаващ фактор RF (от английски език, освобождавайки / актьор), или при прекратяване фактори. Един от тях чрез центъра на пептидил трансфераза катализира хидролитично разцепване на синтезиран пептид от тРНК. Другият за сметка на GTP хидролиза енергия предизвиква разпадането на рибозоми в субединици.
Интересното е, транслационни фактори осъзнават ефекти, дължащи се на хидролиза на GTP, са членове на суперфамилията на G-протеини, който включва G-протеини, които участват в сигналните трансдукционни хормони и други биологично активни вещества и Ras-протеини, които функционират като растежни фактори. Всички G-протеини се свързват и GTP хидролиза. Когато те са свързани към GTP, активното вещество и да участват в съответните метаболитни процеси, и когато в активния сайт в резултат на хидролиза на GTP към БВП се превръща, тези протеини стават неактивни конформация.
Така матрица излъчва характер на процеса проявява с това, че последователността на получаване на аминоацил-тРНК за синтеза на рибозом протеин иРНК строго детерминирана, т.е. реда на кодони по веригата на иРНК недвусмислено определя структурата на синтезиран протеин. На рибозоми иРНК сканиране верига във формата на тризнаци и последователно избира околната среда на "необходимо" аа-тРНК, освобождавайки по време удължаване деацитилиран тРНК.
Малки и големи рибозомна субединица: процесът на транслация имат различни функции: малката субединица иРНК отдава декодира информацията, използвайки тРНК транслокация механизъм и голям subedanitsa отговорен за образуването на пептидни връзки.
polyribosomes
В процеса на синтеза на протеини, рибозомата е прикрепена към 5'-края на мРНК и се движи в посока Z'-края. В този случай на 5'-края на тРНК се освобождава и може да се присъедини към новата рибозома, което след започва друга полипептидна верига. Обикновено в същото време много рибозоми, участващи в синтеза на протеини в същата иРНК, образуващи комплекс, който се нарича polyribosomes или полизоми.
Всяка рибозом иРНК се част около 80 нуклеотида в дължина, така ribrsomy разположени на интервали иРНК е приблизително 100 нуклеотиди. Колкото по-дълго полипептидна верига синтезиран протеин, толкова по-рибозомите могат едновременно да извършват синтеза на този протеин се увеличили значително по този начин ефективно използване на матрицата.
Всяка рибозом е в състояние да катализира образуването на пептидни връзки от около 100 минути. Polyribosomes могат да съществуват под формата на частици, плаващи в цитоплазмата на клетките, или могат да бъдат свързани с ER. Свободните цитоплазмени poliribosomnye частици са отговорни за синтеза на протеини, които изпълняват вътреклетъчни функции. Polyribosomes свързани с ER, под електронен микроскоп, изглеждат като "груб" повърхност. Протеини синтезирани "груб" Спешно отделение, да бъдат транспортирани през мембраната, за да се гарантира, че те достигане на крайната си местоположение. Те се характеризират с присъствието на N-края на лидер, или сигнала, дължината последователност от 15 до 30 аминокиселинни остатъци, която съдържа много радикали хидрофобна аминокиселина и позволява преминаването на протеин през липидните двуслойни мембрани. Някои от тези протеини са пакетирани за по-нататъшно транспортиране на секреторни гранули Голджи.
Транспорт синтезирани протеини през мембрани.
Синтез на митохондриални протеини
В митохондриите на клетки на висшите организми да съдържа до 2% от клетъчната ДНК се различава от ядрото на ДНК. Митохондриите съдържат цялата апаратура, включваща рибозомата, тРНК и MPH К необходими за синтезата на някои протеини. Синтезираните протеини в митохондриите предимно неразтворими са протеини, участващи в организирането на структурата на тези органели, а синтезът на разтворим източник на митохондриални протеини са цитоплазмени рибозоми, където след това се транспортират в митохондриите. Рибозомите в митохондриите са по-малки от рибозомите 80S в цитоплазмата. Интересното е, както иницииращия аминокиселина в синтеза на протеини в еукариотни митохондрии могат да участват N-формилметионин, не свободен метионин като в цитоплазмата. Този факт показва, че митохондриалната синтезата на протеин в неговия механизъм, очевидно, е в близост до синтеза на протеин в прокариоти.
Пост-транслационни модификации на полипептидната верига
Полипептидни вериги могат да претърпят структурни модификации, или докато все още свързан към рибозомите или след синтез е завършена. Тези структурни и структурни промени в полипептидните вериги се наричат пост-транслационни модификации. Те включват отстраняване на част от полипептидната верига, ковалентно прикрепване на един или повече лиганди малка молекула придобиване протеин нативна конформация.
Много се правят модификации в реанимацията. Има възникне сгъването на полипептидните вериги и образуването на уникален третична или четвъртична структура протеин. И за да се запази естествената структура на молекулите е от решаващо значение за правилното формиране на дисулфидни връзки.
частична протеолиза
Много протеини, секретирани от клетките първоначално се синтезират като прекурсорни молекули, които са функционално активна. Премахването на част от специфичните резултати полипептидната верига ендопротеаза в образуване на активни молекули. Някои прекурсорни протеини се разцепват в ER или устройството; Голджи. друга - след секреция. Така неактивни прекурсори на секретират ензими - зимогени - образуване на активния ензим след разцепване на някои части на молекулата: панкреасен трипсиноген зимоген се преобразува в активен трипсин след секреция
Свързани статии
