1.3. химични свойства
1.4. оптичен изомер
2.2. пептидна връзка
Определение: органични съединения, съдържащи в молекулата карбоксил и амино nazyvayutsyaaminokislotami. На амино киселинни остатъци са конструирани протеини - основния материал, от който обектите са направени от дивата природа. Ето защо, аминокиселините са от голямо значение.
1.1. Класификация, номенклатура, изомерия.
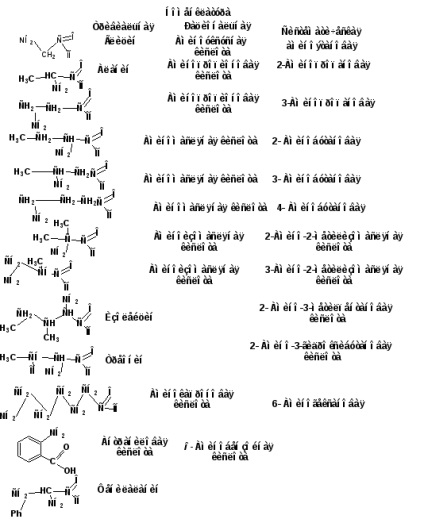
26 α-аминокиселини, от които са изградени протеини, имат свои собствени имена. Например: глицин, аланин, валин, серин, и т.н. Рационално номенклатура се основава на тривиални имена на карбонова киселина се поставят в префикс "амино" и означени с буквата на хидрокси позиция гръцката азбука. Според систематичен номенклатура lokantom на показва позицията на амино групата. Карбоксилна група винаги е на първо място. Заглавие изработена от въглеводород, допълнена с префикс "амино" и наставката "ова" или "diovaya".
Хомоложна серия започва с амино монокарбоксилна aminomuravinoy или частично амид на карбонова киселина. След това идва глицин или глицин, Тези два киселини нямат никакви структурни изомери. изомери на аминокиселини, свързани с позицията на амино групата и структурата на въглеродния скелет. Следователно следните карбоксилни киселини - пропанова - molgut бъдат два изомера, различаващи се по позицията на амино групата: α-амино пропионова киселина и пропионова киселина β- Мино. Киселина с четири въглеродни атома, могат да съществуват под формата на изомери пет. Три съответства п -маслена киселина и два изомаслена киселина.
Всички естествени аминокиселини, с изключение на глицин, съдържат асиметричен въглероден атом. всички те принадлежат към L-серията.
1.2. Методи за получаване
Действието на амоняк на α-халокарбоксилна киселина:
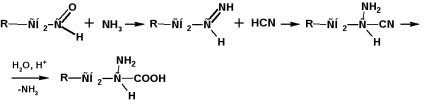
Получаване чрез метода на Strecker-Zelinsky
По този метод алдехидът се обработва с воден разтвор на смес от калиев цианид и амониев хлорид:
амоняк присъединяване на а, Р-ненаситен киселини:
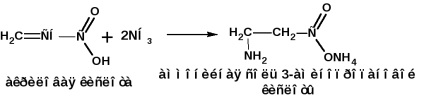
Получаването метод Родионова:
Методи за получаване на други аминокиселини
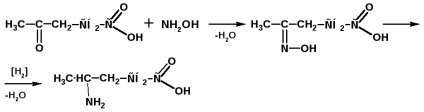
Получаване на γ-амино левулинова киселина:
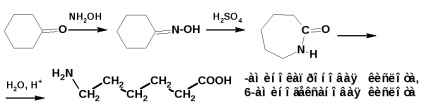
Амино киселини с по-отдалечени един от друг от функционални групи, получени чрез Бекманово прегрупиране. Например, получаването на капролактам и ω-аминокиселини (ω-хексанова киселина)
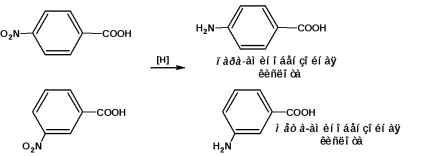
ал - и мета -Aminobeyzoynye киселина получено чрез редуциране на съответното нитробензоена киселина:
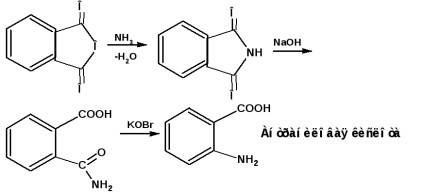
орто изомер. т.нар антранилова киселина се получава от фталов анхидрид, фталимид чрез действието на хипобромит:
1.3. химични свойства
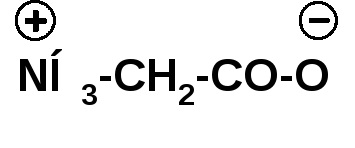
Аминокиселини - безцветно кристално вещество с висока температура на топене, които се различават леко за различни аминокиселини и следователно не са типични. Vekschestva топене е придружено от разлагане. На топене с разлагане характерни соли. Като соли на аминокиселини са лесно разтворими във вода. воден разтвор на амино киселина има неутрална реакция, която също е характеристика на солите. Аминокиселините са така наречените вътрешни соли (биполярни йони):
Такова йон в кисела среда се държи като катион, тъй дисоциация на карбоксилните групи се потиска, и амино киселина в алкална среда се държи като анион:
Стойността на рН, при което максималната концентрация биполярно йон - се нарича изоелектричната точка.
Подобно на други съединения със смесени функции проявяват свойства амино киселини и амини.
Аминокиселините образуват соли с основи. Соли на а-аминокиселини с тежки метали могат да бъдат изчерпателни:
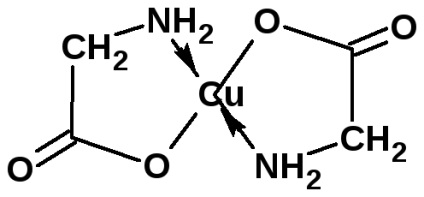
сол има наситен син okrashivaanie.
Аминокиселините образуват соли с неорганични киселини:
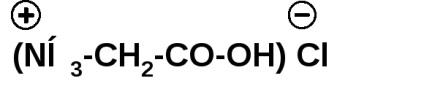
Подобно на други киселини, аминокиселини образуват естери, хлориди, амиди и др:
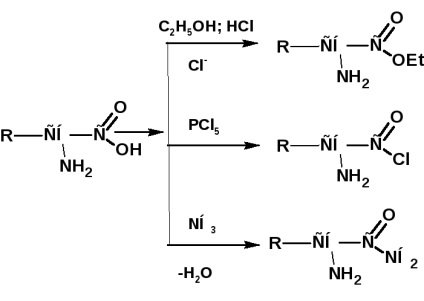
Под действието на азотиста киселина за образуване на хидрокси амино киселина:
Аминогрупата в аминокиселините лесно ацилирани под действието на кисели хлориди и анхидриди:
Алкилирането на амино групата, получен вторични и третични амино киселини. излишък алкил халид Образуваната chetyrehzameschennyeammoniynye база. Вътрешни соли на тези бази се наричат бетаини:
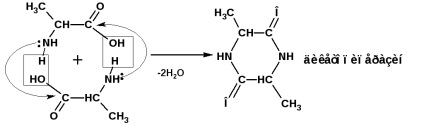
Поведение α, Р и у-амино киселини при нагряване:
а-амино киселини, за да образуват междумолекулни циклични амиди - дикетопиперазини:
β-аминокиселини по молекула отопление амоняк се разцепват до получаване α, β-ненаситена киселина (амониева сол):
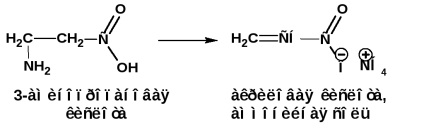
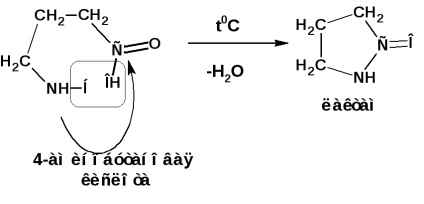
γ и δ-аминокиселини са отцепени чрез загряване на водата и образуват циклична вътрешномолекулни амиди - лактами:
Определение. Протеини - с високо молекулно тегло сложни органични съединения. изградена от аминокиселинни остатъци, свързани заедно чрез амидни връзки.
Протеините се разделят на протеините (прости протеини), които включват само аминокиселинни остатъци и proteid (сложни протеини). Това не само протеини изградени от аминокиселини, но също така и на други вещества, захариди или остатъци, фосфорна киселина и нуклеинови киселини.
Протеините са класифицирани в три групи.
1. разтворимост във вода:
Белтъци - разтворим във вода и разредени солни разтвори.
Глобулини - слабо разтворими във вода и разтворими в разредени разтвори на соли.
Prolamins - неразтворими във вода и разтворими във воден алкохол.
Glutelins - неразтворими във вода, разредени водни разтвори на соли и алкохол, са разтворими в разтвори на киселини и основи.
Фибриларен белтък - неразтворими във вода, разредени солни разтвори, воден алкохол, както и разтвори на киселини и основи.
2. протеиди са класифицирани според продуктите на хидролизата:
Нуклеопротеиди - да хидролизират протеини и нуклеинови киселини.
Fosfoproteidy - да се хидролизира протеини и фосфорна киселина.
Glyukoproteidy - хидролизира на протеини и въглехидрати.
Chromoproteids - хидролизирани протеини на и оцветители.
3. Всички протеини са класифицирани по функции в организма:
Протеини, които контролират метаболизма.
Както аминокиселини, протеини имат амфотерен характер и изоелектрична точка. Регламент изоелектрични точки за протеини могат да варират в широки граници, от киселинни до силно алкална.
Всички протеини са оптически активни. Повечето от тях са напуснали въртене.
Има редица реакции цветни висококачествени протеини за:
1. ksantoproteinovaya с азотна киселина. Протеините се третира с азотна киселина дава жълто оцветяване.
2. биурет с медни соли в присъствието на основа. Протеини дават виолетов цвят се дължи на образуването на комплекс сол.
3. Реакция Millon. От разтвор на живачен нитрат в протеини азотна киселина се получава червено оцветяване.
4. сулфхидрилната. При нагряване с натриеви протеини plumbite разпределени черен оловен сулфид утайка.
Протеините са изградени от остатъци 26 аминокиселини. Аминокиселини се разделят на взаимозаменяеми, които могат да бъдат синтезирани от тялото и от съществено значение, които не са синтезирани от човешкото тяло. Например, изолевцин и треонин.
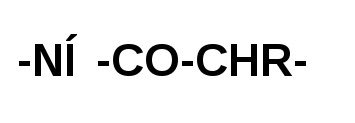
аминокиселинни остатъци в протеин молекула свързани чрез амидни връзки. Амидни връзки в протеини се нарича пептидна връзка:
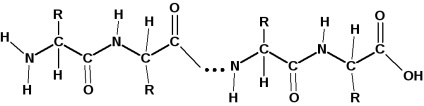
Карбоксилната група на една аминокиселина молекула образува амидна, чрез взаимодействие с молекулата съседна аминокиселина на амино група. отделните пептидни единици:
Те се различават един от друг само радикали «R» когато α-въглероден атом.
Съединения, съдържащи множество аминокиселинни остатъци са наречени пептиди. Свързване с голям брой пептидни единици се наричат полипептиди.
В проучването на полипептиди предимно разберете кои аминокиселини от макромолекулата се конструират, и които амино киселина е N-края (свободна амино група), и която е С-край (свободна korboksilnaya група).
Протеините се хидролизират в аминокиселини равномерно концентрирана солна киселина или 2% солна киселина при загряване и повишено налягане. Хидролизата на протеините може да се проведе под действието на алкален. реагент подбор зависи от конкретните аминокиселини трябва да се получи от протеиновата молекула.
Определяне на N-крайна аминокиселина
Провежда, използвайки 2,4-динитрофлуоробензен:
В реакцията на 2,4-динитрофлуоробензен с пептид флуоро нуклеофилно заместен при крайния амино група. Пептидът след това се подлага на хидролиза. реакционен продукт крайната амино киселина с 2,4-динитрофлуоробензен киселина се изолира и идентифицира. В случаите, когато 2,4-динитрофлуоробензен приложимо - използва фенил изотиоцианат.
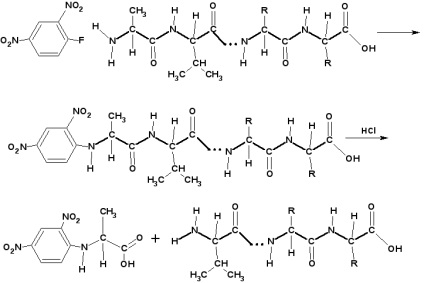
Определяне на С-крайни аминокиселини:
За определяне на С-крайната аминокиселина (с свободна хидроксилна) пептид нагрява с хидразин при 100 0 ° С в продължение на няколко часа. Където всички аминокиселини, с изключение на края за да образуват хидразиди:
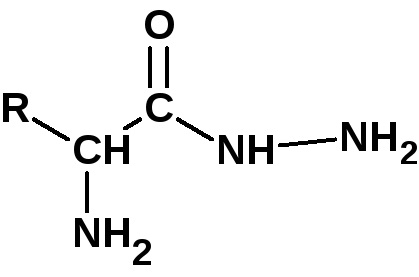
Амино киселина хидразид не се образува е изолиран и идентифициран.
Един прост метод е използването на карбоксипептидаза ензим, който разцепва пептидна връзка само С-терминалната аминокиселина. Тя може да бъде изолиран и идентифициран.
Изграждане на полипептидната верига се извършва чрез метод E.Fishera. Методът се основава на използването на киселинни хлориди а-galogenzameschennh киселини. Например, необходимо е да се получи по веригата:
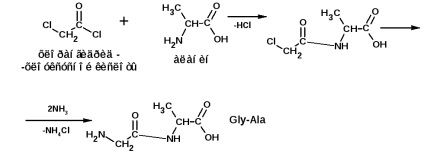
и alaninglitsinvalin (Ala-Gly-Val):
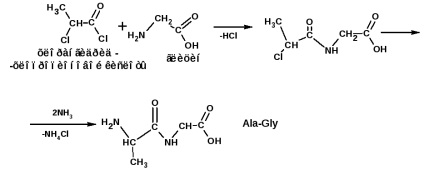
Аминокиселинната последователност, ковалентно свързан с полипептид, е така наречената основна структура на протеина. Но всъщност полипептидната протеин все още не е така. Пептиди може да функционира. Или за да изпълнява функция в организма в състояние на по-усъвършенствани системи изградени от няколко полипептидни вериги по специфичен начин, свързани един с друг. Супрамолекулните структури образувани polopeptidnymi вериги, характеризиращи се с вторична, третична и четвъртична структура протеин.
Вторична структура се определя чрез водородно свързване между пептид не е свързан с кислород и карбонилната група на амино водородни групи. Ако карбонила и амино група принадлежат към различни полипептидни вериги, тогава като вторична структура се нарича β-структура. Ако карбонила и амино група принадлежат към една и съща полипептидна верига, като вторична структура се нарича α-структура. В резултат на α-структура е наличието на полипептидната верига, под формата на спирално навит на цилиндър. Дължината на един остатък от 1.5 спирална дължина стъпка е 0. 5.4 0. водородни връзки α-спирала, образуван между всеки от първия и четвъртия аминокиселина.
Третичната структура на протеин, образуван чрез сгъване или окабеляване няколко а-спирали. В тази спирала се провеждат близо един до друг, поради водородни връзки, образувани от страничните амино, хидрокси и карбоксилни групи, както и дисулфидни връзки и Електростатично.
На четвъртичната структура е оформена като съвкупност от няколко полипептидни вериги, имащи вторична и третична структура. Полипептидни вериги се провеждат в четвъртичната структура на същите сили, както в третичната структура.
Унищожаване на първичен вторична, третична и четвъртична структура, наречена протеин денатуриране. Денатурирането може да бъде причинено от топлинна (топлина), химични, механични и т. D. Тази денатурация е обратим и необратим. Необратими денатурация се свързват с разрушаването на първична и вторична структура. След тяхното унищожаване на протеина не спонтанно възстановена. Например, хидролиза на протеини или яйца готвене или месо от разбиване белтъка. Денатурация третична и четвъртична структура е обратимо. След тяхното унищожаване на белтъци могат спонтанно се възстанови с връщането на биологичните функции. Например, приключи косата на ролки (термично денатуриране), или къдрене от kopeните.
Свързани статии
