За разредени разтвори право Раулт е формулиран, както следва: налягане на парите наситен разтвор на разтворител (Р1) пропорционално на молната фракция на разтворител в разтвора (N1):
където P10 - парното налягане над чист разтворител.
В разтвори на ангажира всеки компонент се подчинява правото Раулт, която в този случай е написано, както следва:
където
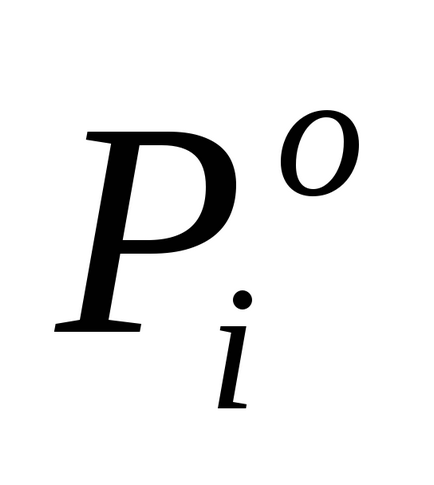
В този случай, общото налягане на парите през разтвора е равна на сумата на частичните налягания на пара компоненти на разтвора:
Раулт уравнение, което взема предвид дисоциацията на разтвореното вещество в разредени разтвори, има формата:
където I - изотоничен Van't Hoff фактор показва колко пъти увеличава броя на частиците в разтвора поради дисоциация, и свързани със степента на дисоциация на а от следното равенство:
където ν- брой частици в който молекулата се дисоциират в разтвор.
В зависимост повишаване точката на кипене (ΔTkip = T -.. Tokip), и по-ниска температура на замръзване на разредени разтвори на концентрации на разтворите са изразени чрез следните уравнения за вещества nedissotsiiruyuschih (Т = ΔTzam Tozam.-).
и уравненията за дисоцииране вещества
Къде Tokip. Tozam. - замразяване и температурата на кипене на чистия разтворител;
т- молалност на разтвора;
Cab. и KCR. - ebulioskopicheskaya и cryoscopic константи на разтворител, в зависимост от природата и не зависят от естеството на разтворените вещества. Стойностите на тези константи са дадени в справочна литература.
Чрез повишаване на температурата на кипене (ebulioskopichesky изследвания метод - ebullioscope) или понижаване на точката на замръзване (cryoscopic метод -krioskopiya Research) разредени разтвори могат да бъдат изчислени концентрация rastvorovm. изотоничен koeffitsienti. степента на дисоциация на разтваря veschestvaα и има предвид, че молалност се дава от (2,5), неговата моларен massuM2:
ПРИМЕР Пример 2.2. Налягането на наситена водна пара над разтвор нелетливи вещества във вода е под 2% парно налягане над чиста вода. Определя молалност на разтвора. Моларното маса M1 вода = 18 гр / мол.
R е т н д
Ние считаме, молната част на разтвореното вещество в разтвора, за които ние използваме закона уравнение на Раулт (2.7):
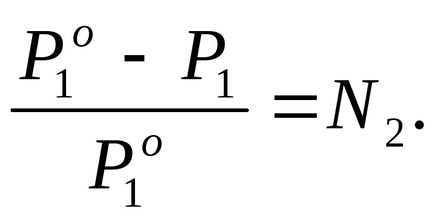
Според изявлението на проблема P1 2% по-ниска
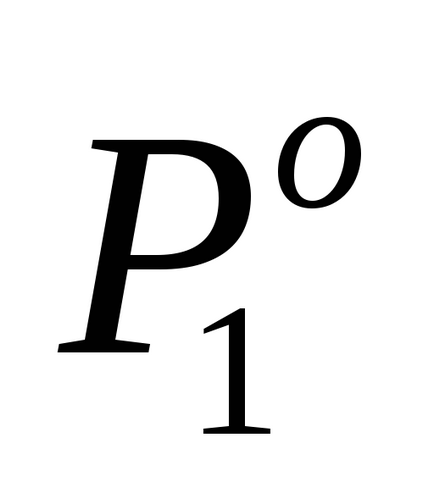
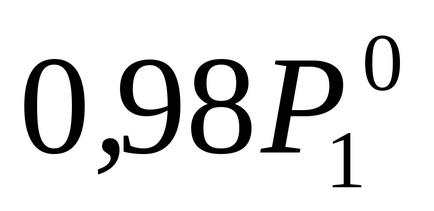
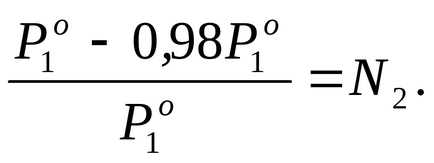
За да се определи молалност м изчисляване на броя на моловете разтваря veschestvan2. попадащи в разтвор на 1000 г вода. Това sluchaem = n2.
Броят на мола вода на 1000 гр е:
В съответствие с дефиницията (2.2) може да се напише изразяване на молната фракция на разтвореното вещество:
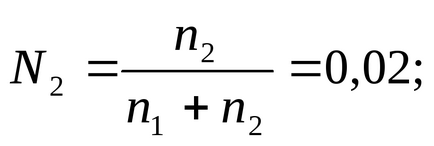
в който да замени на N1 стойност. вместо n2-т. и да намерят тази стойност:
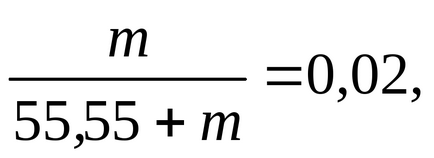
m = 1,134 мол / 1000 г вода.
ПРИМЕР Пример 2.3. Изчислете общото налягане на парите през двоичен идеалното решение при температура 313 К, състояща се от 200 г дихлороетан C2H4Cl2 (EDC) и 350гр benzolaC6H6 (В). ако налягането на парите на тези чисти вещества при тази температура са: RoDHE = 2,066 х 10 4 Ра, и
Ние намираме броя на моловете на компонентите в разтвора:
общия брой молове на вещества:
Изчислява молната фракция на всеки компонент в разтвора:
Парно налягане над разтвора на всеки компонент е от закона уравнение Раулт за перфектни разтвори (2.7):
Общото налягане се изчислява съгласно уравнение (2.8):
ПРИМЕР Пример 2.4. Изчислява точката на замръзване (кристализация) 1% S разтвор на сяра в желязо Fe. Ако температурата на кристализация на чисто желязо е 1813 К, и KCR. = 101,5 K / мол. Сярата молна маса 32 грама / мол.
Ако разтворът съдържа 1% на разтвореното вещество в 100 г от този разтвор съдържа 1 г сяра и 99 грама g2 g1 желязо. Изчислете молалност разтвор на сяра в желязо съгласно уравнение (2.5):
Намаляването на замръзване оценка уравнение (2.12):
замразяване температурата на разтвор на сяра в желязо на:
ПРИМЕР Пример 2.5. Изчислете колко етилен (ОН) 2 се добавя С2Н4 до 500 г вода G1. за понижаване на точката на замръзване на разтвора при 3 градуса. Cryoscopic постоянна KCR вода. = 1.86 ° С / мол. Моларен маса M2 етилен = 62 грам / мол.
Намираме молалност от решението на уравнение (2.15):
От формула (2.5) за изчисляване на молалност:
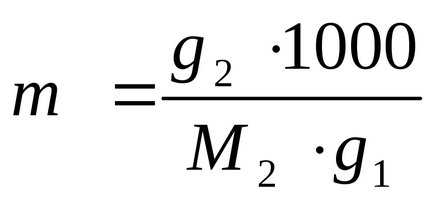
Ние изразяваме и очакваме стойност g2:
ПРИМЕР Пример 2.6. Изчислява се моларната маса на веществото, ако температурата на замръзване на разтвор, съдържащ 200 г бензол и 0.4 гр g1 аналит g2. 0,17 К под точката на замръзване на бензен. Cryoscopic постоянна KCR бензол. = 5, 16 K / мол.
Изчисляване като се използва формулата (2.18) за cryoscopic:
ПРИМЕР Пример 2.7. Изчислява видимата дисоциационна степента BaCl2 сол в 3,2% воден разтвор, ако температурата на кипене на водния разтвор е равно на 100,21 С моларната маса на бариев хлорид 208 гр / мол. Ebulioskopicheskaya вода постоянно кабината. = .512 ° С / мол.
Ние определи молалност на разтвора съгласно формулата:
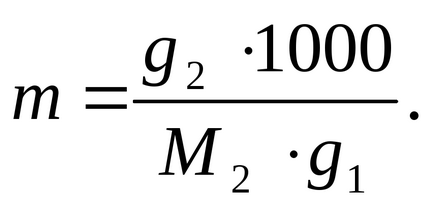
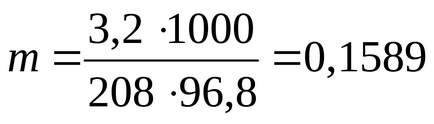
където 100 ° С - точка на кипене на чистия разтворител (вода).
Ние считаме, факторът Van't Hoff от уравнение (2.17):
.
Степента на дисоциация α е намерена от отношението (2.10)
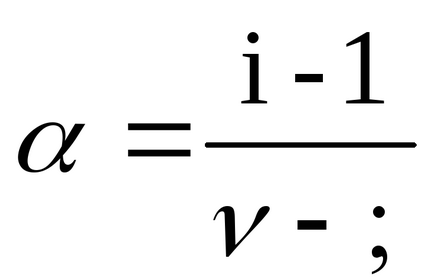
за BaCl2ν = 3, от дисоциацията на единична молекула на солта са оформени три йон;
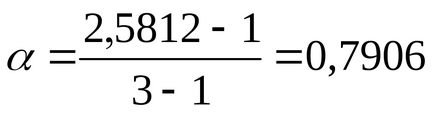
Полученият степента на дисоциация за силна електролита е видно и вярно в близост до 1 съгласно теорията Арениус.
Свързани статии
