РЕЗЮМЕ хидролиза намалява химическо взаимодействие на обменни катиони или аниони на солите с водните молекули. В резултат на това взаимодействие се образува malodissotsiiruyuschee съединение (слаб електролит). Излишък на свободни йони на Н + или ОН появява във воден разтвор на сол -. и солите, разтворът става киселинни или алкални, съответно.
2. Соли, образувани със силна киселина и слаба основа.
Да разгледаме хидролиза на амониев хлорид, на NH4CI.
Две процеси се провеждат във воден разтвор на сол:
1) лека обратим дисоциация на водни молекули (много слаб електролит амфотерен), които могат да бъдат написани опростенчески като се използва уравнението:
2) пълно разпадане на солта (силно електролит):
По този начин образува йони ОН - NH4 + и си взаимодействат един с друг, за да се получи NH3 · Н2 О (слаб електролит), докато H + йони остават в разтвор, като по този начин причинява му кисела среда.
Пълна хидролиза йонен уравнение:
Процесът е обратим, химичното равновесие се измества към образуването на изходните материали, т.е. водата да Н2 О - .. електролит е значително по-слаба от хидрат на амоняк NH3 · Н2 О.
Съкратено йон хидролиза уравнение:
Уравнението показва, че:
1) в разтвора е свободен от водород йони Н +. и концентрацията им е по-голяма, отколкото в чиста вода, така че разтворът на сол има кисела среда (рН <7);
2) реакция с вода, участващи амониеви катиони NH4 +; в този случай ние казваме, че е хидролиза на катиони.
Реакцията с вода могат да участват и да се размножават заредени катиони: M 2+ двойно зареден (например, Ni2 +, Си2 + Zn2 + ..), различни от катиони на алкалоземни метали, тройно М 3+ (например, Fe 3 +, Al 3+ , Cr 3+.).
Да разгледаме хидролиза никелов нитрат Ni (NO3) 2.
Това се случва, сол с катион хидролиза Ni2 +.
Пълна хидролиза йонен уравнение:
Кратко йонни уравнение:
продуктите на хидролизата - NiOHNO3 основна сол и азотна киселина, HNO3.
воден разтвор на никелов нитрат киселинност на средата (рН <7), потому что в растворе увеличивается концентрация ионов Н + .
Хидролиза NiOHNO3 сол се среща в много по-малка степен, и могат да бъдат пренебрегвани. По този начин:
1) сол от катиона, обикновено обратимо хидролизира;
2) химически равновесни реакции силно измества наляво;
3) реакционната среда в солеви разтвори, като кисела (рН <7);
4) хидролиза на соли, образувани mnogokislotnymi слаби основи се получават базични соли.
3. Соли, образувани със слаба основа и слаба киселина.
Такива соли се подлагат на хидролиза и катион и анион.
ЗАПОМНЕТЕ. Възможност и природата на хидролиза се определя от базовата естеството и киселини, от които се образува солта.
Катион слаба основа йони свързва ОН - от водните молекули, се образува слаба основа; слабо анионни киселина се свързва Н + йони от водните молекули, се образува слаба киселина. Реакционните разтвори на тези соли могат да бъдат неутрални, слабо киселинни или слабо алкални. Това зависи от дисоциационните константи на две слаби електролити - киселини и основи, които се получават чрез хидролиза.
Например да разгледаме две хидролиза на соли: амониев ацетат NH4 СН3 COO и формиат ammoniyaNH4 HCCO:
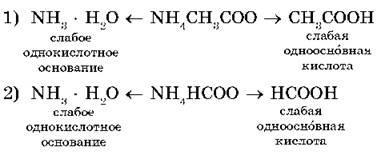
Водните разтвори на тези соли на слаба основа катиони NH4 + реагират с хидроксилни йони ОН - (припомни, че вода дисоциира) и аниони на слаби kislotCH3 COO - и НСОО - взаимодействат с катиони на Н +, за да образуват молекули слаби киселини - оцетна СН3 СООН и мравчена НСООН.
Ние напиши уравнение йон хидролиза:
В тези случаи, хидролизата е обратима, но равновесието се измества към образуването на хидролизни продукти - две слаби електролити.
В първия случай, разтворът от неутрален (рН = 7), т.е.. К. A CD (CH3 СООН) = KD (NH3 · Н 2О) = 1,8 · 10 -5. В последния случай средата ще бъде слабо кисел разтвор (рН <7), т. к. КД (НСООН) = 2,1 · 10 -4 и KД (NH3 · Н2 О) <КД (НСООН), где КД — константа диссоциации.
Хидролиза на повечето соли е обратим процес. равновесие Химическата хидролизира само част от солта. Въпреки това, някои сол се разлага напълно с вода, т. Е. им хидролиза е необратим процес.
Al2 S3 алуминий сулфид във вода се подлага на необратима хидролиза, т.е. да се появи, когато хидролизата на катион Н + йони обвързващите образува чрез хидролиза на аниона ОН йони .. -. Това подобрява хидролиза води до образуване на неразтворим алуминиев хидроксид и газообразен сероводород:
Следователно Al2 S3 алуминий сулфид не може да се получи чрез взаимодействие на водни разтвори на обмена между двете соли, например алуминиев хлорид AlCl3 и натриев сулфид Na2 S.
В резултат на хидролиза и катион и анион:
1) Ако солта и хидролизиран катион и анион обратим, химичното равновесие на реакциите на хидролиза се измества надясно; където реакционната среда или неутрална или слабо кисела или слабо алкална, в зависимост от съотношението на дисоциационните константи на основи и киселини се образуват;
2) соли и може да се хидролизира чрез катион и анион необратимо, ако поне един от продуктите на хидролизата от сферата на реакцията.
Свързани статии
