Ние приемаме вещество в течна форма и е разположена с наситен пара в равновесие и без да се променя обемът стане отнеме топлина. Този процес е придружено с намаляване на температурата на вещество и съответно намаляване на налягането. Следователно, точката представлява състоянието на материята в диаграмата (р, T), се движи надолу кривата на изпаряване (фиг. 47а). Това продължава дотогава, докато температурата на кристализация на веществото, което съответства на равновесие стойност на налягане. Ще означаваме тази температура Ttr. През цялото време преминава процес на кристализация, температурата и налягането остават непроменени. Изтеглени през тази топлина е топлината, освободена по време на кристализацията.
Фиг. 47. диаграми на
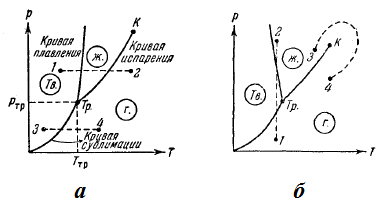
TTR температурата и съответния PTR равновесие налягане - само температурата и налягането, при което може да бъде в равновесие три фази на материята: твърди, течни и газообразни. Съответната точка на диаграмата (р, Т) се казва, тройна точка. По този начин, тройната точка определя условията, при които могат да бъдат в равновесие в същото време трите фази на материята.
В края на процеса на кристализация при равновесие ще бъде твърда и газообразна фаза. Ако продължите да отнеме топлината от материала, Петя Буюклиева-perature започва да спада. Съответно понижено налягане на парите, с кристалната фаза в равновесие. Въпросът, показваща състояние на материята, се премества надолу крива сублимация.
Температурата на тройната точка е температурата, при която материалът се топи, а при равен PTR под налягане. В друг натиск, температурата на топене ще бъде различен. Връзката между налягане и температура, представено чрез топене, кривата на топене, с начало на тройната точка. По този начин, тройната точка лежи в пресечната точка на три криви, определяне на условията за равновесие на двете фази, твърди и течни, течни и газообразни и накрая твърди и газообразни.
В зависимост от съотношението между обемите на специфични твърди и течни фази на кривата на топене е или като на фиг. 47а. или като на фиг. 47б.
Топенето криви, изпаряване и сублимация координатна равнина е разделен на три зони. От ляво на сублимация и топене криви се намира в района на твърдата фаза, между кривите и зоната на топене изпаряването се затворени течни състояния и накрая отдясно на изпарението на криви и сублимация област се простира газообразни състояния на веществото. Всяка точка в една от тези области представлява подходящ еднофазен състояние на материята (през цялото време имаме предвид само равновесие състояние, т.е.. Д., като състоянието, в което има значение, колкото е по-дълъг престой при постоянна външни условия). Всяка точка лъжа, която има за цел определяне на границите на региона едно от кривите показва състоянието на равновесие на двете фази на съответното вещество. Тройната точка представлява равновесно състояние на всички три фази.
По този начин, всяка точка в графиката показва известно равновесно състояние на материята. Ето защо, той се нарича фазова диаграма.
Диаграмата на фаза, която се базира на експериментални данни, позволява да се прецени състоянието на дадено вещество при определени р и Т, както и който фазови преходи ще настъпят в даден процес. (. Фигура 47а) Например, при условия, съответстващи на точка 1, веществото е в твърдо състояние, при 2 - в газа, и във всяка точка на кривата на топене - както в течни и твърди състояния. Да приемем, че веществото в твърдо състояние, съответстващ на точка 1, се подлага изобарно нагряване, изобразен на фазовата диаграма хоризонталната пунктираната линия 1 -2. Фигурата показва, че при температура съответстваща на сечението на пунктираната линия с кривата на топене, веществото се топи при по-висока температура, съответстваща на пресечната точка с 1-2 права крива изпаряване започва да се превръща в газ. Ако веществото е в твърдо състояние, съответстващ на точка 3, кристалът се превръща в газ без да минава през течната фаза под изобарно нагряване (пунктирана линия 3-4). Ако състояние диаграма има формата, показан на фиг. 47б. изотермични компресия от състояние 1 до състояние 2 от газова фаза материал ще премине в твърдото вещество и след това в течност.
Изпаряването крива завършва в критичната точка К. Следователно непрекъснат преход е възможно от течно вещество газообразно състояние и обратно до критичната точка. без да пресичат кривата на изпаряване (преход 3-4 на фиг. 47Ь), т. е. на преход, който не е придружен от фазови превръщания. Това е възможно, тъй като разликата между газа и течността е чисто количествен (както тези състояния, например, са изотропни). Преходът на кристално състояние (характеризиращ анизотропия) в течен или газ може да бъде само рязко (в резултат на фазов преход), така топене и сублимация криви не могат да бъдат прекъснати, както е в случая на кривата на изпаряване при критичната точка. Топене крива отива до безкрайност, и кривата е сублимиране, където р = 0 и Т = 0.
Свързани статии
