таблица на съдържанието
електроотрицателност
Химията се използва широко понятие Електроотрицателност (ЕО) - собственост на атома на елемента за забавяне на електрони от атомите на други елементи в съединенията, посочени Електроотрицателност. Електроотрицателност литиев условно се приема като единица, ЕО и други елементи се изчисляват съответно. Съществува широк спектър от стойности на елементи EO.
Числени стойности на членовете на етиленов оксид са приблизителни: тя е безразмерна величина. Колкото по-висока елемент ЕО, по-ярко прояви своите метални свойства. EA елементи могат да бъдат написани, както следва:
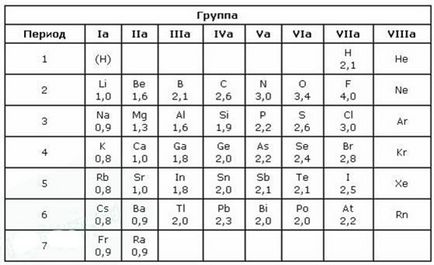
F> О> Cl> Вг> S> P> C> H> Si> Al> Mg> Са> Na> K> Cs

Най-високата стойност на ИА е флуоро. Сравнявайки стойностите от Франция EA елементи (0,86) до флуорид (4.1) е лесно да се забележи, че се подчинява ЕО периодичен закон. В ЕО Периодичната система на елементите в периода се увеличава с увеличаване на атомен номер (в ляво) и в основните подгрупи - намаляване (надолу). В периоди с увеличаване на заряд на ядра броя атомната на електрони в най-външния слой се увеличава, атомен радиус намалява, така лекотата на откатни електрони намалява, увеличава EO следователно амплифицирани неметални свойства.
Разликата в electronegativities на елементи в съединението (ΔX) позволяват да се прецени вида на химична връзка.
Ако стойност Δ X = 0 - ковалентна връзка неполярен.
Когато разликата в Електроотрицателност до 2.0 ковалентна връзка се нарича полярен. например: връзката в молекула флуороводород HF HF: Δ X = (3,98 - 2,20) = 1,78
Поради разликата в Електроотрицателност над 2.0 се считат за йонен. Например: връзката във връзка NaCl NaCl: Δ X = (3,16 - 0,93) = 2,23.
Електроотрицателност зависи от разстоянието между вътрешните и валентни електрони, както и за това как в близост до корпуса на валенция запълнена. По-малкият атомен радиус и по-високите валентни електрони, толкова по-висока от омбудсмана.
Флуорът е най-електроотрицателен елемент. Първо, тя има на електрон валентността обвивка 7 (липсва всички октета до 1-ва електрона), и второ, че обвивката на валентността, разположен в близост до ядрото.
Електроотрицателност може да бъде количествено и изграждане на елементи в серия от възходящите му. Най-често се използва скалата на electronegativities, предложен от американски химик L. Полинг.
окисляване степен
Композитен материал, състоящ се от две химични елементи, наречени двоичен (Bi лат -. Две), или от два елемента (NaCl, солна киселина). В случай на йонна връзка в молекулата NaCl натриев атом предава външната електрон атом на хлор и се трансформира с йон с зареждане на една и хлорен атом приема електрон, и се превръща в йон с зареждане на -1. Схематично, процесът на превръщане на атомите, към йони могат да бъдат представени, както следва:
В химична реакция на молекула HCl общо електронна двойка се измества към по-електроотрицателна атом. .. Например ,, т.е. електрон не напълно премине от водороден атом, атом хлор, и в частност, като по този начин причинява частично зареждане атома δ: Н Cl 0,18 -0,18. Ако присъства като молекула HCI, като в хлорид NaCl, електрон напълно предава от водороден атом с атом на хлор, те ще получи заряд на един и 1:
Тези условия се наричат такса за целия окисление. При определяне на това понятие условно предполагат, че ковалентни връзки на полярното съединение проводима електроните са напълно включени към електронно-trootritsatelnomu атом и следователно съединения с-стои само на положително и отрицателно заредени атоми.
Степента на окисление - кондиционираната заряд е химичен елемент атоми в съединението, изчислен като се приеме, че всички връзки (и йонни и ковалентни-полярен) се състоят само от йони. Степента на окисление може да има отрицателно, или положително нула, която обикновено се поставя над елемент символ от по-горе, например:
Отрицателна стойност на окисление са тези атоми, които са взети от електрони или други атоми, към които споделят електронни двойки са изместени, т.е.. Е. Атомите повече електроотрицателни елементи. Положителната стойност на окисление са тези атоми, които дават своите електрони на друг атом или които са съставени от общите електронни двойки, т.е.. Е. малко електроотрицателни атоми елементи. Стойност нула окисление са атомите в молекули и атоми на прости вещества в свободно състояние, например:
В съединенията с общата степен на окисление винаги е нула.

валентност
Химическа валентност елемент атом се определя основно от броя на несдвоени електрони, участващи в химичното свързване.
Valence възможности атоми се определят:
• броят на несвоен електрони (една електронните орбити на);
• наличие на свободни орбитали;
• присъствието на несподелени електронни двойки.
В органичната химия, терминът "валентността" замества терминът "степен на окисление", която обичайно работят в неорганична химия. Все пак, това не е едно и също нещо. Валенцията не слага и не може да бъде нула, а степента на окисление се изисква и се характеризира марка може да има стойност, равна на нула.
Като цяло, по валентността се отнася до способността на атоми за образуване на определен брой ковалентни връзки. Ако атом има несдвоени електрони пит неразделен електронни двойки, този атом могат да образуват N + м ковалентни връзки с други атоми, т.е. е равно на валентността на п + m. При оценката на максималната валентност трябва да се основава на електронната конфигурация на "развълнуван" състояние. Например, максималният атомната валентност на берилий, бор и азот е 4.
- Н, Na, Li, К, Rb, Cs - Окисляване I
- О, Be, Mg, Са, Sr, Ва, Ra, Zn, Cd - Окисляване II
- В, Al, Ga, In - Окисляване III
Използване валентности може да се образува съединение с формула.
Химична формула - Условно запис е Състав на вещество с помощта на химически символите и индексите.
Например: Н2 О-формула вода, където H и О-химични признаци елементи 2 - индекс, който показва броя на атоми на елемент, принадлежащ към молекулата на водата.
Когато имената на веществата с променлива валентност трябва да посочат валентност, която се поставя в скоби. Например, Р2 05 - фосфорен оксид (V)
I. Степента на окисление на свободни атоми в молекулите и атоми на прости вещества nulyu- Na0, P40, D2 0
II. В комплекс вещество алгебрична сума на всички атоми на СО по отношение на техните индекси нула = 0 и комплекс йон на заряда.
Нека разгледаме например, няколко връзки и признае валентност хлор:
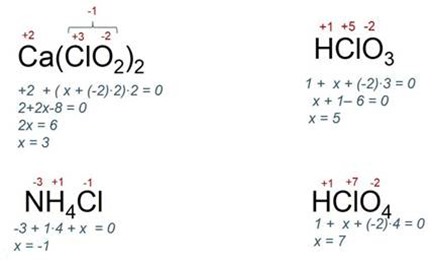

Предистория Материал за изследване:


Свързани статии
