Тема - 18: Подгрупа кислород. Алотропия кислород и сяра. Характерни елементи от подгрупите на кислород. Сравнение на свойствата на водородни съединения.
· Характеристики на структурата на атома в Група VI.
· На свойства, състав, получаването и използването на най-важните химически съединения.
· За характеризиране на общи свойства на неметалните елементи от група VI.
Съставки Химическа формула водородни съединения, киселини.
18.1. Обща характеристика
Основната група елементи VI група образуват коте lorod (О), сяра (S), селен (Se), телур (Te) и полоний (Po) с група, наречена "халогените", което означава, vperevode "rudoobrazovateli".
Структурата на външен електронен атомен слой ns2np4 под-група. същото ниво на структура валентността определя сходство халкоген всички те се отнасят ksemeystvu р-елементи са неметали (kromepoloniya). Като външният слой 6 на електроните, елементи атома данни, свързани с липсващите октетите 2 електрони, и в съединенията проявяват по-ниска степен на окисление равна на (- 2).
Сяра, селен, телур и полоний и опорна образуващи съединение Alikhan'yan и сътр, в която те проявяват положителна целия окисление.
Електрон графичен формула халкоген атома в основната (без напрежение) състояние:
Наличието на две несдвоени електрони, което води типичен всички halkogenoov валентност равна-Ing II.
Във всички халкоген атоми (различни от кислород) в количката-възбудено състояние може да се увеличи броят nespa-rennyh електроните поради електрон преход SNR - поднива-ин на svobodnyynd подслой. В този случай, след валентно състояние на атома:
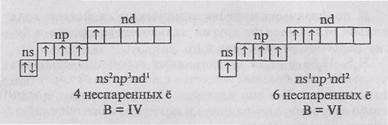
Тъй като валентността на кислородния атом са елек-Trona второ ниво, без да има г-подслой, кислородните атоми в възбудено състояние прехода на не-възможно. Следователно кислород има постоянна валентността-ност P.
Сяра, селен и телур с кислород в съединенията са про-окисление 4 и 6. Тези елементи образуват Obra тип оксиди EO2 и EO3 които имат киселинен характер. Съответните хидроокиси са коте партиди. Силни включват само сярна киселина и селен, други са много слаби. С увеличаване на степента на окисление се увеличава и киселинни и окислителни свойства хидрокси-редове и съответните киселини.
халогените и водородни съединения проявяват всички еквивалентност на равно II (окисление на -2).
H2S, H2Se и N2Te представляват най-обикновени условия на газообразни вещества с неприятна миризма характер Ним. Всички от тях са отровни. Когато се разтваря във вода, слабо дисоциират на йони и следователно са слаби киселини MI. Степента на дисоциация се увеличава леко по време на прехода от H2S да N2Te. В същата посока е намалена устойчивост на молекулите (чрез нагряване и H2Se N2Te разлагане).
Всички съединения на селен и телур са отровни.
Сравнение на основните елементи на подгрупи VI. и VII групи, както и техните съединения води до следните заключения:
1. халкоген метални свойства са изразени HN-слаба от тази на халоген.
2. кислород халкоген съединения (оксиди и киселини) е много по-стабилна в това, халоген-нова.
3.Halkogenovodorody (с изключение на вода) от по-малко полярен и по-силен от халогениди на водород.
4. В подгрупата на разликите между халкоген елементи-ните са по-изразен отколкото в подгрупата на халоген-нова.
Най-важното в основната подгрупа VI трупата са кислород и сяра, и техните съединения.
18.2 кислород и неговите съединения
В състояние на кислород без това съществува в две модификации: алотропна O2 - кислород и О3 - озон.
О2 кислород при нормални условия - газ е безцветна и без мирис; Т = -183 ° С; малко по-тежък от въздуха, сал-Нес 1.43. Слабо разтворим във вода: 1 L с п. у. RA-stvoryaetsya = 0.07 гр. Течен кислород - мобилен, леко синкав течност.
Ozone O3 при нормални условия - газ синьо, с остър мирис; Точка на кипене = -112 ° С Разтворимостта във вода е по-висока от тази на кислород. Liquid озон -субстанция тъмно синьо, почти черно. Взривни във всички състояния на агрегация, като спонтанно се разлага Xia с освобождаването на големи количества енергия.
18.2.1 Получаване на свободен кислород
Много чист кислород, произведен от разлагане на електролит-агенция вода в присъствието на електролит (за-пример, W '
При лабораторни условия, кислород могат да бъдат получени чрез разлагане при нагряване нестабилна Съед-neny съдържащ кислород в състава си, например:

Озонът е оформен в горната част на атмосферата (на височина-CHO около 50 км) на свободен кислород. Под въздействието на ултравиолетови лъчения кислородни молекули раз-sotsiiruyut за производство на атомен кислород:
18.2.2. Химически свойства на кислород
В реакцията на O2 с прости вещества - Me-талий и неметали - обикновено образуват оксиди, например:
Въпреки това, има и изключения. Например, когато кислородни lenii-оксиди на алкални метали като натрий и калий, образуват предимно пероксиди (А-С светодиоди yavlyayutsyapobochnym продукт):
Почти всички реакции, включващи O2 екзотермична, с малки изключения:
Характерна особеност на много реакции, свързани с кислород ЛИЗАЦИЯ е изолирането на топлина и светлина. Такива реакции се наричат горене.
Много сложни съединения също се окисляват кисели родения. При взаимодействието на O2 с водород свързан niyami неметални вода се образува, и които не са единични място etsya или в свободно състояние или под формата на приложение-Sid, в зависимост от условията на реакцията:
Под влияние на кислород по-ниски оксиди и хидроксиди в съответното съединение с ви-sokoy окисляване:
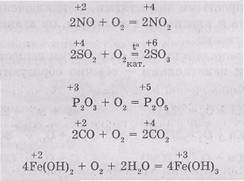
Кислородът изгори почти всички органични
вещества. пълно окисление продукти са глави NYM начин, въглероден диоксид и вода.
18.2.3. водороден прекис
Е безцветна течност с точка на топене = -0,41ºS и т.к. = 150, 2 ° С и плътност 1,45 г / см3. Pure водороден пероксид е експлозив.
Разтвор на водороден пероксид е кисела, поради неговата молекулна дисоциация на типа на слаба киселина:
Някои метални пероксиди, например Na2O2, BaO2, могат да се разглеждат като слаби соли на перокси и водород киселина. От тях можете да получите ефекта на H2O2-бо Лий силни киселини:
Пероксиди се характеризират с присъствието на молекулите на пероксидни кислородни атоми на веригата;
18.3.1. Сярата и неговите съединения
сяра относителна Електроотрицателност е много по-ниска от тази на кислород, така че в сравнение оксиди, способността сяра възпалително силно отслабени, Lena.
Въпреки това, сяра образува стабилно съединение с водород и метал, който е в окислено състояние -2, Но, за разлика от кислород, сяра susche-съществува в съединения в положителен окисление. Най-важните съединения, образувани от сяра в различни окислителни състояния включват следното:
свободен серен 18.3.2Allotropiya
В един прост сяра вещество има голям брой алотропна модификации различни между съвместно борба състав и молекулярна структура. Броят на атомите в мол-kulah различни алотропия на сяра варира в широк диапазон на ком - от 3 до 20; молекули могат да имат CEC-циклично и линейна структура.
При нормални условия, съществува сярата в модификация диамант-изч. Неговите молекули съдържат 8 серни атоми свързани с единични ковалентни връзки в затворен цикъл.
Ромбично сяра - кристално твърдо вещество vesche-ЛИЗАЦИЯ жълто, почти неразтворим във вода, но лесно се разтваря във въглероден дисулфид CS2 и ацетон.
При температури над 95 ° С ромбично сяра предварително завърта в моноклинна промяната: стопена сяра съдържа почти всички алотропия.
При лабораторни условия, свободен серен може по luchit на съединенията от реакции на окисление-Вос-stanovitelnyh, например:
18.3.3. Химичните свойства на сяра
Сяра - реактивен неметали. Известен съединенията с почти всички елементи, различни от инертни газове, злато и платина метали.
При взаимодействие с прости вещества образуващи ен-елементи с по-малък ЕО, показва серни оксиди - свойства: S0 + две грама → S2-
При взаимодействие с прости вещества образуващи ен-елементи с по-голяма EO, серни експонати нд-stanovitelnye свойства:
По този начин, сяра изгаряне във въздуха синкав пламък, образуван по този начин серен диоксид:
Флуор сяра запалва дори при нормално изпарят-D с образуването на серен хексафлуорид:
S + 3f2 → SF6
Хлор и бром взаимодействат със сяра при леко нагряване до образуване халогениди, например:
S + Cl2 → SCl2
Водните разтвори на основи при нагряване под сяра jected автоокисляване - лекува (диспропорциониране):
Водороден сулфид H2S - безцветен, токсичен газ силно неприятна миризма; Т.т. = -. 85 ° С и т.к. = -60 ° С Ra разваляне на AQ можно H2S във вода е ниска (при стайна температура тура в един обем вода се разтварят 2,5 H2S обем).
В природата, сероводород се образува в големи аудио изход СЛЕДВА дължи на биохимични процеси.
Бактерии, които произвеждат H2S са Горският от тях организми на Земята. Сероводород също се намира в вулканични газове и вода минерални извори.
В промишлеността и в лабораторията на полу-сулфид chayut действие на силни киселини на метални сулфиди.
Както двуосновен, сероводородна киселина Obra-zuet две серии на соли - сулфиди и hydrosulfides. За разлика от повечето сулфиди, hydrosulfides хо Rosho се разтварят във вода.
Сулфидите и hydrosulfides по-малка степен в разтвор на вода-TION се подлага на хидролиза, тъй като те OB razovany слаба киселина. Например:
къмпинг в оксиди, понякога сулфати, и понякога излъчват си Bodnya метал.
Някои от сулфидите имат променлив състав. зало-
lisulfidy, например, железен (II) образува няколко
сулфиди, от които най-важните Фес (сулфид
желязо) и FeS2 (желязо дисулфид). Причината е, че,
че серните атоми в състава на сулфид могат да образуват
между ковалентна връзка (така наречените "сулфидни мостове"). Графични формула FeS2 както следва:
За натриевите полисулфиди известни променлива с затвора до Na2S2 Na2S5. Когато жълт разтвор на поли-сулфид пренапрежение солна киселина, има половин mnogosernistyh разлагане на метал за образуване на H2S-ем и S.
18.3.5. серни оксиди
Сярата с кислородни форми няколко оксиди, но само две са стабилни: SO2 - серен оксид (IV) и SO3 - серен оксид (VI). Свойствата на тези съединения, NY има прилики и разлики.
Като типични неметални оксиди, и двете от тях са коте lotny характер, имат по-силно изразена SO3. Въпреки това, различни степени на окисление на серен атом в SO2 и SO3 причинява съществена разлика в агент-ционни свойствата на окисляване за намаляване на тези съединения.
Излагане химични свойства типичен киселинни окиси, сяра и серен триоксид разтваря взаимодействие:
а) с бази, които образуват два вида соли: и кисела среда.
SO2 + NaOH → NaHSO3 натриев бисулфит
SO3 + NaOH → NaHSO4 натриев хидрогенсулфат
б) с основни оксиди
SO2 + СаО → CaSO3 калциев сулфит
SO3 + СаО → CaSO4 калциев сулфат
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Сернистата анхидрид. В молекули SO2 серни атоми имат междинно окисление на (4), така съчетава серен диоксид и окислител и намаляване на способността, последният пре-
Свързани статии
