Структурата на свиването саркомера и мускулната
• Myosin II е мотор, който осигурява свиването на мускулите
• актин и миозин II са основните компоненти на саркомера, основна единица на набраздени мускулни контракции
Мускулната тъкан са способни редукция, която осигурява мобилност и движението на орган на тялото. В съответствие с появата на контрактилните влакна, мускулите могат да бъдат разделени на две основни групи: набраздената и гладка. Набраздени мускулните влакна са така наречените защото при високи увеличения могат да видят характеристика набраздяване. Тази група включва скелетните и сърдечните мускули.
Скелетните мускули осигуряват мобилност на равнището на скелет и сърцето на сърцето. Влакната на гладките мускули не са набраздени и имат шпиндел форма. Тези мускули образуват стените на органи като мехур, кръвоносните съдове и стомашно-чревния тракт.
Motor протеин, който осигурява свиването на мускулите, принадлежи към семейството на миозин II. Това миозин е един от най-често срещаните гръбначни протеини, той лесно се откроява и поради това е един от най-добре проучени протеини.
Фигурата по-долу показва структурата на молекулите миозинови II, състоящи се от шест полипептидни вериги: две тежки и две групи, всяка от които се състои от две леки вериги.
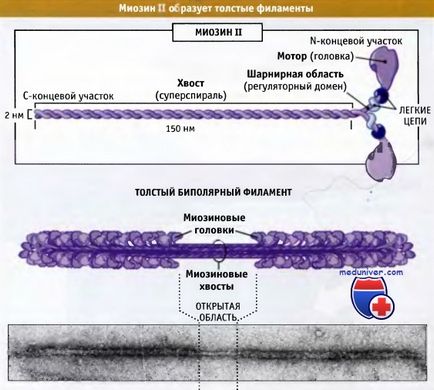
състоящ се от две тежки вериги и две двойки от различни леки вериги.
Тези комплекси са събрани в биполярни дебели нишки.
Дисталната част на опашката мускул миозин на II молекули, свързани с други миозин II, за да се образува влакна, състоящи се от приблизително 300 от миозинови молекули. Тези влакна са биполярни и моторни домейни на миозини са насочени от централната зона. Тези влакна се наричат биполярни дебели нишки. В този раздел ще обсъдим организацията и ролята на миозин II в намаляването на набразден мускул. Тези въпроси са добре разбрани.
Набраздени мускули се състоят от пакети на мускулните влакна. Последните са големи многоядрени клетки, продължителността на който варира от няколко милиметра до няколко сантиметра и диаметър от 20-100 микрона. Фигурата по-долу показва, че всеки мускулните влакна се състои от повече от 1000 миофибрили, които са пръчковидните органели, които са способни на редукция. На миофибрили са изградени от повтарящи се единици, наречени саркомери. Саркомери разположени един зад друг и са отговорни за характеристика набраздяване на мускулите.
Саркомери са основна единица на набраздения мускул потрепване; когато свиване и отпускане на мускулите дължина промени. Както е показано по-долу, съдържа саркомери дебели влакна, съставени главно от биполярни нишките на миозин II, и тънки нишки, които съдържат актинови филаменти и регулаторни протеини. Пернат края на актиновите нишки, от една страна, свързани със структурата на саркомера, който се нарича Z-диск. По този начин всички актинови филаменти от едната страна Z задвижване имат една и съща полярност.
Актин нишки са прикрепени към Z-диска и копирани чрез свързване към протеин осезател (CapZ), който пречи на деполимеризацията на нишките на актин. Посочените краищата на влакната актин са ориентирани в посока към центъра на саркомера и копират Tropomodulin. Тъй актиновите нишки също взаимодейства nebulin протеин; тя може да регулира сглобяването на влакната и дължината на тънък спиралата.
Дебели нишки са в центъра, на М-линия, между Z-дискове. М-линия е структура, съдържаща гъвкаво свързани биполярни дебели нишки; тези връзки закрепване дебелите влакна, разположени във вътрешността на шестоъгълник. Заедно с белтъчни нишки М линия наречени титанови форми еластична връзка между Z-дискове и миозинови влакна. Titinius осигурява центриране на дебелите влакна в саркомера, и действа като пружина, която предотвратява участък на саркомера.
Тънки и дебели нишки са преплетени, образува триизмерна решетка. Тъй като биполярно саркомера, и в двете половини на миозиновите двигатели по отношение на актин се по същия начин, ориентирани. С намаляването на моторното домен на миозинови дебели нишки взаимодействат с актиновите тънки нишки. С намаляването на саркомера се скъсява чрез плъзгане на тънки и дебели влакна един спрямо друг, което води съседните Z-дискове до центъра на саркомера. Както се премести миозинови глави назъбени краища на актинови филаменти, продължителността на дебели и тънки влакна е гладно.
Ширината на спокойна мускулна саркомера в гръбначните животни е около 3 микрона, като същевременно се намалява става около 2.4 микрона.
групи на мускулните влакна са съкратени. състояща се от хиляди саркомери, което води до съкращаване на цялата мускулатура. Общата дължина на скъсени мускулни влакна се определя от два фактора: дължината на която съкратен всеки саркомера, и броят на саркомери в групата. Процент размер, за които има скъсяване на мускулните влакна е една и съща, независимо от тяхната дължина.
Количеството на сила, генерирана от саркомера. пропорционална на броя акто-миозинови взаимодействия половината саркомера, и количеството на сила, която се развива myshchnoe влакно е пропорционална на броя на паралелни саркомери. По този начин, вдигане на тежести увеличават тяхната сила чрез увеличаване на площта на напречното сечение на мускулите, не се дължи на тяхната дължина.
Както е показано на фигурата по-долу, намаляването на набраздения мускул се регулира с tropomiozinovogo тропонин комплекс, който се свързва с актин в тънките влакна. Тропомиозина молекули са полипептиди суперспирални 40 нм. Тя постави един зад друг по спиралата на актин. Troponin е комплекс от три различни протеини: тропонин С, тропонин I и тропонин Т. комплекс се свързва с тропомиозина, така че те са разположени по протежение на тънки нишки 40 интервали пМ.
При ниски концентрации на калциеви йони тропомиозина е в такова състояние, че космическите блокира свързването сайт на миозин за актин, така че мускул релаксира и АТР хидролиза от миозин ефект е много бавен. Чрез взаимодействието на актин с миозинови-спокойна саркомери способни пасивен напрежение, оказва слабо съпротивление.
Нервните импулси предизвика освобождаване на калций в цитозола от саркоплазмения ретикулум. Последното е органел, че калциеви отлагания в мускулите. Повишени нива на цитозолен калций води до неговото свързване към тропонин-C, и конформационни промени в протеиновата молекула. В резултат на тези промени тропомиозина се отдалечава от мястото на миозин-задължителен за актин и миозин е в състояние да си взаимодействат с преструват и genernirovat усилия от механохимия цикъл.
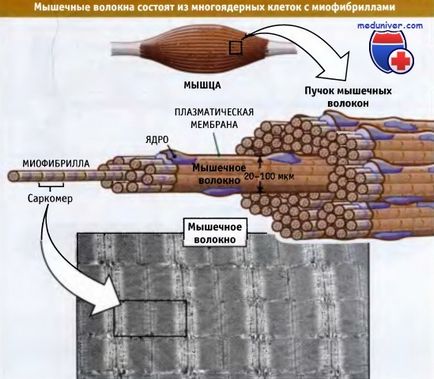
Миофибрили са в състояние да се намали и да съдържа повтарящи се единици, наречени саркомери.
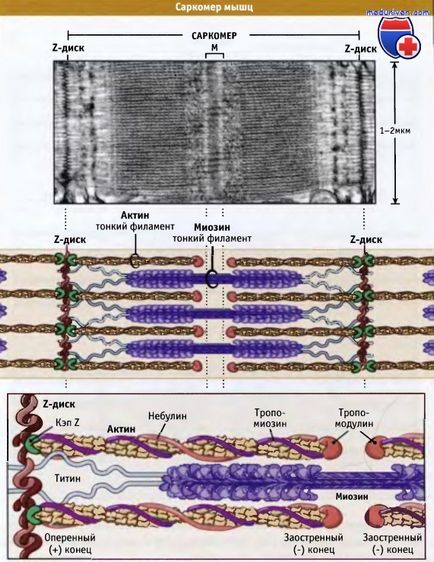
Дебели миозинови нишки са свързани с Z-диск и чрез протеин Titinius тъкани между актин filmentami.
Nebulin тече от Z-диск, за да Tropomodulin. Въпреки това, тъй като тя се свързва актин, тя все още е неизвестен.
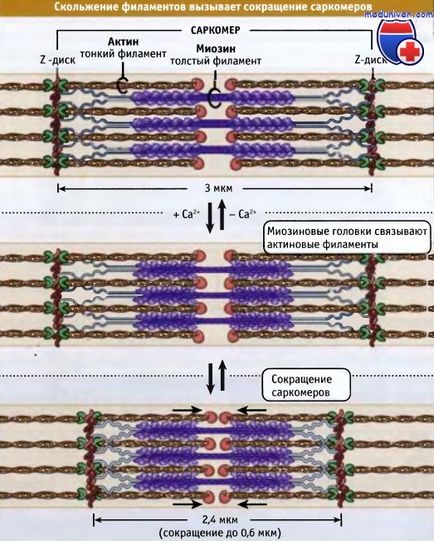
че Z-дискове са изместени един спрямо друг. В този намалява дължината на саркомера.
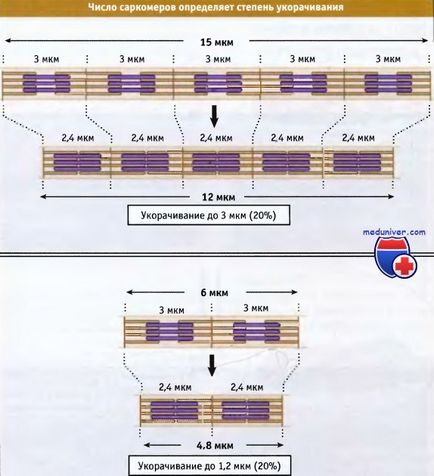
Въпреки това, процентът на стойността на мазнината не зависи от броя на саркомери.
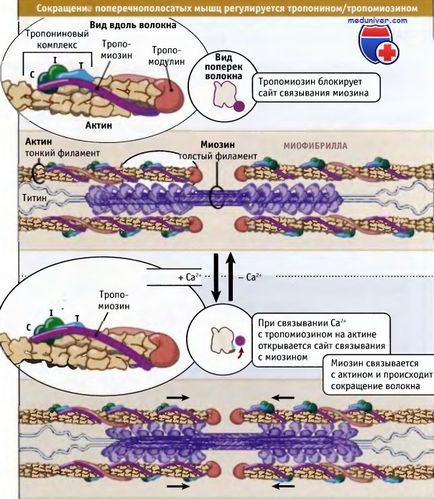
който определя позицията на комплекс тропонин / тропомиозина относително миозин и актин.
