Общи характеристики на сяра
Сяра - шестнадесетия елемент от периодичната таблица. Определяне - S от Латинска «сяра на задачите». Разположен в третия период, VIA група. Това се отнася до не-метали. ядрен заряд е 16.
Сярата се среща естествено в свободно състояние (роден сяра) и в различни съединения. Много разпространени серни съединения с различни метали. Много от тях са ценни руди (например, галенит PBS, цинков сфалерит ZnS, халкоцит Cu2 S) и служи като източник на цветни метали.
Серни съединения в природата са общи сулфати, главно калциеви и магнезиеви Накрая, серни съединения, съдържащи се в растителните и животинските организми.
Атомна и молекулна маса на сярата
Относителна молекулна маса на веществото (н) - е число показва колко пъти масата на молекулата дълги 1/12 тегло въглеродни атома, и относителната атомна маса елемент (Аг) - колко пъти средното тегло на атоми на химичен елемент е по-голяма от атомната маса на 1/12 въглерод.
Стойностите на атомно и молекулно тегло съвпадат сяра; те са равни на 32,059.
Алотропия алотропна модификации и сяра
Сярата съществува в две модификации алотропна - ромбично и моноклинни.
При нормални налягания серни форми крехки жълти кристали, които се топят при 112,8 ° С; плътност от 2.07 гр / см 3. Той е неразтворим във вода, но доста разтворими във въглероден дисулфид, бензен и други течности. За изпаряване на течната сяра от разтвора под формата на жълти кристали от орторомбична система с форма на осмоъгълниците, който обикновено е част от ъглите или ръбове, тъй като се нарязва (Фигура 1). Тази модификация се нарича ромбично сяра.
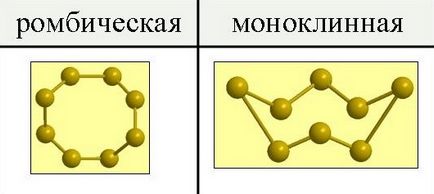
Фиг. 1. алотропна модификация на сяра.
Други форми на кристали се получават чрез бавно охлаждане стопена сяра и когато той частично се втвърдява сливат все още не е имал време да се втвърди течността. При тези условия, стените на кръвоносните съдове са облицовани отвътре с дълги тъмно жълти игловидни кристали от моноклинна система. Тази модификация се нарича моноклинна сяра. Той има плътност от 1.96 гр / см 3. топи при 119.3 ° С и е стабилен само при температура над 96 ° С
серни изотопи
Известно е, че естеството на сяра може да бъде под формата на четири стабилни изотопи, 32 S, 33 S, 34 S и 36 S. тяхната маса номера 32, 33, 34 и 36, съответно. Ядрото на серен атом изотоп S 32 съдържа шестнадесет шестнадесет протони и неутрони, и 33 S изотоп на, 34 S и 36 S- същия брой протони, седемнадесет, осемнадесет и двадесет неутрони съответно.
Там изкуствени серни изотопи с масови числа от 26 до 49 минути, най-стабилен е S 35 с период на полуразпад, равна на 87 дни.
На външната енергийно ниво на серен атом има шест електрони, които са валентността:
1s 2s 2 2 2 2p 6 3s 3P 4.
В резултат на химическо взаимодействие между сяра може да загубят валентните електрони, т.е. да им донор, и се превръща в положително заредени йони или приема електрони от друг атом, т.е. да им акцептор, и да стане отрицателно заредени йони:
S 0 → S 6+ -6e;
S 0 → S -4e 4+;
S 0 → S -4e 2+;
S о + 2е → S 2-.
Молекула и серен атом
Едноатомен молекула сяра - С. представи някои свойства, характеризиращи серен атом и молекула:
Свързани статии
