На кипене е преходна фаза, при което превръщането на течност за пара, с мехурчета пари, образувани в целия обем на течност.
Температурата на кипене течност се нарича температурата, при която налягането на наситената пара на тази течност равно на външното. При тази температура и съответния наситен равновесие парно налягане между течни и газообразни фази (скорост на изпарение е равна на степента на кондензация), и двете фази могат да съществуват за дълго време. Ако течност - отделно вещество и външно налягане не се променя, то кипене в отворен съд при постоянна температура настъпва, докато напълно изчезва течна фаза. Температурата, при която течността кипи в този 101325 Ра налягане, наречен нормалната температура на кипене.
Замразяване (втвърдяване) представлява преход фаза, при което се образуват превръщането на течността в твърда чиито частици (кристали) в целия обем на течност.
Точка на замръзване (кристализация) течност се нарича температурата, при която налягането на парите на течността е равно на налягането на наситената пара горе спада от кристалите на твърдата фаза. При тази температура и съответния наситен пара равновесие между налягане течни и твърди фази (скорост на кристализация е скоростта на топене) и двете фази могат да съществуват заедно за дълго време. Ако течност - отделно вещество и външен натиск остава постоянно, тогава, когато това се охлажда температурата остава постоянна, съответстваща на температурата на замръзване, докато до пълното втвърдяване.
За да се измести равновесието към температурата на кристализация трябва да се намали, тъй кристализация - е екзотермичен процес. Ако разтваря в течна за вещество, неговата концентрация ще намалее и течността в системата - твърда фаза ще се увеличи процеса на топене. Оттук и връзката (закон II Раулт):
Повишаване температурата на кипене, както и понижаване на температурата на кристализация на разредения разтвор е пряко пропорционална на молалност на разтвора и не зависи от естеството на веществото.
където: IR - ebullioskopicheskaya и cryoscopic константа (в зависимост от естеството на разтворителя, не зависи от концентрацията на природата и вещество)
Информацията и механизми на образуване на течни разтвори варират, така че създаването на единна теория на решения, свързани със значителни трудности. Има няколко гледни точки относно характера на разтворите на: физически, химически и комплекса.
Механизмът на разтваряне под комплекс модел може да бъде представен като три стъпки: 1) ориентацията на молекулите на полярните разтворители около частиците на разтвореното вещество, йонни формация - дипол връзки; 2) пробие връзки в разтвора; 3) разтваряне на йони в разтвор.
Първите две фази са свързани с разход на енергия, а третият с неговото пускане. съотношение енергия определя топлина на разтваряне и по този начин екзотермичният процес или ендотер на процеса на разтваряне.
Известно е, че в структурата на течност в междинно положение между газовете в която молекулите са подредени на случаен принцип, и кристалите, където частиците са определени разстояния един от друг в кристалната решетка. Течностите са запазени някои елементи на поръчаната структура. Например, смята се, че лед вода частично запазва структурата, в която всяка молекула има четири водородни връзки със съседните молекули.
В образува разтвор поради нови сили взаимодействие между частиците се нарушава структурата чисти течности. Налице е нова структура с различно разположение на частиците и други между тях взаимодействие. Всичко това зависи до голяма степен процесите, които протичат в разтвори.
разтвор свойства по същество зависи от неговия състав. Ето защо най-важните характеристики на разтвора са концентрация на компоненти. Начини за изразяване на различни концентрации. По-вероятно е да се използва:
1. Моларното фракция - съотношението на I - компонент Ni. съдържаща се в разтвора, общото количество на материята в системата 1 п.
2.Obemnaya дял - съотношението на обем заета от I - компонент на Vi. Общият обем система V.
3. Маса фракция - тегловно съотношение на I - компонент (мл) към общото тегло М на системата.
4. моларна концентрация - съотношението на I - компонент Ni. на обема заета от V. на системата
Моларна концентрация се изразява в мол / m 3 мол / л. Позволени обозначението М.
5. molal концентрация или молалност - съотношение на I - компонент Ni. т.т. тегло на разтворителя.
Molal концентрация се изразява в мола / кг. Например, терминът "odnomolyalny разтвор" означава разтвор, съдържащ един мол разтворено вещество в 1 кг разтворител.
6. моларен еквивалент концентрация - съотношението на еквивалента и вещество с обема заета от системата.
Моларен еквивалент концентрация се изразява в мол / m 3 мол / л. Това позволява наименование п.
При въвеждане на разтвореното вещество в разтворителя разтваряне процес - с течение на времето спонтанно, т.е. разтворът се ненаситен, след това разтвор може да премине има редица вещества. Когато разтворът се насища, че в такава система може да съществува съвместно за неопределено време без - всеки разтвор промени и излишък от разтворено вещество. състояние на равновесие могат да бъдат разделени само поради промени температура, налягане, или въвеждането на други вещества. На свръхнаситен разтвор на концентрацията на веществото е по-висока, отколкото в наситени (при дадена температура и налягане), може да бъде получено внимателно и бавно охлаждане на наситен температурата високо солеви разтвор на слаба киселина (тиосулфати и ацетати на алкални метали). Свръхнаситен разтвор е система, която е в очевиден равновесие. Разклащането или влизащи в нея кристали от едно и също вещество, което е в разтвор, кристализация, там е разпределение на излишък от разтворено вещество и разтворът се насища.
Разтворимостта на веществото е равна на концентрацията му в наситен разтвор. За различни вещества варира в широки граници. Абсолютно никакви неразтворими вещества. Разтворимост зависи от естеството на веществото, състояние на агрегиране и външни условия (температура, налягане и т.н.). След разтваряне на някои вещества имат договаряне - обем система компресия: разтвор обем е малко по-малко от размера на разтвореното вещество и разтворителя. По този начин, чрез смесване на 48 обема вода с 52 обема етанол при температура 293 К вместо 100 обема на сместа, получена само 96.3. Това се дължи на взаимодействието на алкохол и вода, за да образуват хидрати и vzaimouplotneniem техните молекули в пространството.
Газове са разтворими в телесни течности, но не безкрайна, но до известна граница, образуването на съответния наситен разтвор. След достигане на състояние на насищане на динамично равновесие е установено между разтвора и газ над него. Това равновесие се характеризира с това, че времето за единица броя на газови молекули в течността чрез нейната повърхност е равен на броя на молекулите на газа, излизащ от течността.
Разтварянето на газове почти винаги придружени от топлинна енергия (поради разтворимостта на молекулите). Според принцип Le Шателие за разтворимостта на газове намалява с повишаване на температурата и се повишава с охлаждане.
Закона на Хенри (1803) изразява зависимостта на разтворимостта на газ под налягане: разтворимостта на газа в течността е пропорционална на натиска си над течността: С = CR,
където С - концентрация на газ в течност, к на - коефициент на пропорционалност в зависимост от естеството на газа, р - налягането на газа над разтвора.
Обемът на разтворен газ е независим от външното налягане, като налягането се увеличи със същия коефициент увеличава концентрацията на разтворен газ и газа над разтвора. Така, разтворимостта на газа в течността е пропорционална на частичното налягане.
Парциалното налягане на азот е около 4 пъти парциалното налягане на кислорода. Следователно, чрез увеличаване на налягането, разтворът се обогатява с азот.
Такива разтвори са идеални, формирането на компоненти, които, взети по подобен агрегатно състояние и във всяко съотношение, не се придружава от промени в обема и термичен ефект, и изменение в ентропията е равна на промяната на ентропията време на смесването на идеалните газове:
право Далтон: Когато разтворени газове в течна смес, всеки газ се разтваря директно пропорционална на частичното налягане.
В зависимост от естеството на течностите, изграждащи системата, се различават:
системи, състоящи се от безкрайно смесващи се течности (вода и етилов алкохол, вода и оцет същност)
системи, състоящи се от ограничен разтварящи течности в един друг (вода и анилин, вода и етер)
система от практически неразтворим във всеки други течности (вода и бензин, вода и живак).
Температурата, при която ограничената разтворимост става неограничен, нарича критичната температура на разтвор.
Взаимното разтворимостта на компонентите може да се увеличава или намалява чрез въвеждане на трети компонент.
Например, анилин може да бъде безкрайно смесим с вода при всички температури, ако системата съдържа достатъчно количество от литиев йодид (т. К. сол е еднакво добре разтворим в двете течности). Понякога въвеждането на третия компонент позволява да прехвърляте хомогенна двуфазен разтвор. Например, за да се разграничи от етилов алкохол воден разтвор, е достатъчно да се добави кристален поташ и се разклаща енергично. След утаяване, разтворът се разделя на две несмесващи слоеве.
Обикновено, разтвори, лекувани твърди вещества в течности. Свойства на решения се подчиняват на трите закона, формулирани от Раул и четвъртата - Van't Hoff.
Свойствата на разредени разтвори не зависят от естеството на веществото, и зависи само от концентрацията наречен Collegiate. Те включват осмотичното налягане, понижаване на налягането на парите през разтвора, понижаващи температурата на кристализация и увеличаване на точката на кипене на разтвора.
Според налягане право пара Раулт на горния разтвор на разредена е по-ниска, отколкото през чист разтворител.
Важна роля в тялото на растения и животни играе феномен на осмоза. Осмоза - едностранно процес дифузия разтворител чрез полупропусклива мембрана от разтвор с ниска концентрация на разтвор с висока концентрация.
В разредени разтвори осмоза не зависи изрично от вида на разтворено вещество и разтворител. Изключително важно концентрация разтвор. Материалите, през която минава разтворители и не преминават разтворено вещество, наречено полупропусклива.
Van't - Hoff:
Големината на осмотичното налягане зависи от концентрацията на разтвореното вещество.
Нарушаването на осмоза и промяната на осмотичното налягане в организма води до нежелани последици. Намаляването на осмотичното налягане, причинено от въвеждането в организма на голямо количество излишък от вода или от загубата на соли, като пот. Това може да предизвика повръщане, припадъци, и по-тежки случаи - да доведе до смъртта на организма. Повишената осмотичното налягане поради въвеждането в организма на излишък от сол и вода преразпределение, в резултат на тъканите натрупват излишните соли и подуване.
Осмотичното налягане е една от причините за движението на водни растения и повдигне от корен горе. От листа на растения, под въздействието на атмосферни процеси, водата се изпарява, загубата се компенсира от осмотичното всмукване на стволовите клетки.
Разтвор разлика чист разтворител не се замразява при постоянна температура. Кристали започват да престои при което - същата температура като температурата намалява броя им нараства до целия разтвор се превръща в твърда фаза. Температурата, при която полученият разтвор се охлажда образуване на кристали започва да се нарича температура на замръзване на разтвора. при замразяване температура на кристалите на разтворителя са в равновесие с разтвор на даден състав.
Опитът показва, че разреденият разтвор замръзва при по-ниска температура, отколкото на чистия разтворител. Разликата между температурата на замръзване и разтвор на разтворителя се нарича понижаване на точката на замръзване # 916; т.
K - cryoscopic постоянна. Тази стойност е числено равна odnomolyalnogo понижаване на точката на замръзване на разтвора, при условие, че тя остава перфектно. и разтвореното вещество не е разграничи и сътрудници. Cryoscopic константа зависи от естеството на разтворителя и не зависи от характера на разтвореното вещество. Вода - 1.86; към фенол - 7.27, бензен - 5.10 CGC / мол. Това означава, че когато са разтворени в тези разтворители, ще се спазват същите концентрации на вещество, равна на най-голямото намаляване на температурата на замръзване в фенол малката във вода.
В резултат на понижаване на налягането на парите по-горе разтвор увеличава енергонезависима въпроса за температурата на кипене разтвор. Наличието на разтвореното вещество води до повишаване на температурата на кипене на разтвора.
E - ebullioskopicheskaya постоянна. Това зависи от разтворителя. Вода 0.51, фенол - 3.04.
Трябва да се помни, че температури над разтвор на кипене в сравнение с температурата на водата кипене. Следователно изгаряния от кипи разтвори повече от болезнени изгаряния кипящи разтворители.
Лекция 4 "електролитна дисоциация във воден разтвор"
Вещество - електролити са:
1. разтворими основи - алкални,
2. киселини
3. разтворима сол.
Оксид електролити не са, т. За да. Те не просто се разтваря във вода и влиза в химична реакция, образувайки хидроксид, които се срещат dissotsiiruet.Neredko вещество, чиито молекули са се наблюдават два вида връзка. Например, в натриева основа - NaOH натриев gidroksogrupp свързан с йонна връзка, водород и кислород - ковалентна. В молекула H 2SO 4 Сярна киселина водородна връзка с киселина Остатъкът от по-полярния от сяра връзка с кислород. алуминиев нитрат Al (NO3) 3 алуминиев свързан с киселинен остатък йонна връзка и азотните атоми, към кислородни атоми - ковалентна. В такива случаи, разпадане на молекулата на йони се извършва в мястото на най-йонни или полярни връзки за разцепване, която изисква по-малко енергия.
От това следва, че йони може да се образува не само на отделните атоми, но групи от атоми. Например SO4 2-. NO3 -. ОН -.
въведе концепцията на степента на дисоциация за количествено характеризиране на електролитна дисоциация (а):
а = -----. където п - брой молекули на твърдо вещество, разделен на йони;
N N - брой молекули на веществото, въведени в разтвора.
В зависимост от степента на дисоциация на всички електролити условно разделена на силен (а = 1) и слабите (а<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
За силни електролити включват силни минерални киселини HCI, H 2SO 4. HNO3. HMnO4 и сътр. Алкални и алкалоземни метали, както и всички разтворими соли.
Слабите електролити включват почти всички органични вещества, слаба киселина Н2 CO3. Н2 S, HNO2. H2 SiO3. Н 3РО 4, останалата база, и много от Н2 О двоични съединения, оксиди и други.
При написването на уравненията на електролитната дисоциация, имайте предвид, че:
дисоциация на многоосновни киселини и основи mnogokislotnyh настъпва постепенно;
силни електролити дисоциация уравнение на първия етап се записват като необратим процес, както и за всички последващи - като реверсивен (с изключение на алкални и алкалоземни метали).
слаби електролити се разпадат обратимо във всички етапи на:
Амфотерните хидроксиди са слаби електролити и се разпадат както на база вида и типа киселина от:
За да се характеризира слабите електролити, използвани количество нарича константа на дисоциация.
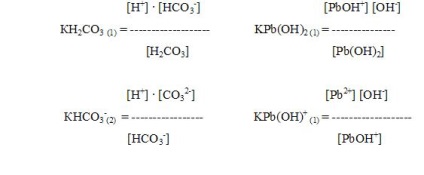
Константата на дисоциация и степента на дисоциация са в математическата връзката (законът на разреждане). с намаляване на концентрацията разтвор (С) степента на дисоциация (а) електролитни увеличава.
От закона на разреждане могат да бъдат получени от формули свързани дисоциационна константа на слаб електролит, степента на дисоциация и концентрацията на йон (Сион). В действителност, тъй
Лесно е да се види, че като Сион и С = а Сион = K / С
Свързани статии
