Дори и през Средновековието, химици са забелязали, че някои от химичните елементи, подобни един на друг по редица свойства и композиции са образувани от тях. Постепенно целия набор от елементи, за да се разпределят естествен семейство. комбиниране на свързаните елементи. Сред тях са, например, семейството на алкален метал и семейството на халогена. През XIX век, са открити повече и повече нови закони в свойствата на елементите, и химици са започнали да се направи опит да се съчетаят в единна система цялото множество от известни елементи.
Natural серия от химични елементи, в която са подредени по увеличаване на атомния номер Z, на великия учен е успял да получи от стойностите на атомни тегла на елементите, които в тази серия също са склонни да се увеличи. Въз основа на честотата на имотите, наблюдавани в естествени числа, Менделеев формулира периодичния закон и да приключи подредбата на елементите. Modern формулировка периодично право, както следва: "Свойства на химични елементи и техния състав и свойства на съединенията са в периодично в зависимост от заряда на атомните ядра."
Геният на отваряне на Менделеев е, че учените са били в състояние да улови естествената връзка на атомния номер и химични свойства, без никаква възможност да го обясня, тъй като няма нищо по това време не е бил наясно с ядрото на атома или електронен слой, или валентен електрон.
Така се ражда периодичната система на химичните елементи. обхващаща и организиране на всички елементи, без изключение. Има огромен брой възможности за графичния дисплей на системата, но най-често срещаният вариант на електронната таблица. Сегашния си вид е показан на следващата фигура.
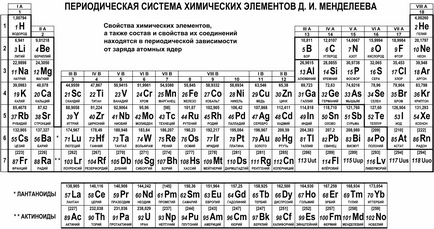
Природен серия от химични елементи в периодичната таблица се намира в седем хоризонтални редове, наречен периоди и са номерирани от 1 до 7 (лантаниди и актиниди принадлежат към шестия и седмия период, съответно, и предоставени в отделни редове от съображения за удобство). Първите три фази се наричат малките. защото те съдържат малък брой елементи (2 или 8); периодите на почивка, посочени голям. като всяка от тях са голям брой елементи (18 или 32).
Natural семейство от елементи са подредени във вертикални колони на таблицата - групи. Освен номериране групи чрез номерата от 1 до 18, обозначението с римски цифри I до VIII и буквите А (основна) или В (страничен). Например, семейството на алкални метали (Li, Na, К, Rb, Cs, FR) е в групата IA, и така наречените монетна метали (Cu, Ag, Au) - в група IB; семейство на халогени (F, CI, Br, I, В) принадлежи към група VIIA, и благородни газове (He, Ne, Ar, Кг, Хе, Rn) принадлежат към групата VIIIA.
Интересно е да се знае! Първоначалната версия на елементите в таблицата, включена половината от броя на елементите, а някои от тях са били поставени по различен начин. С откриването на нови елементи и развитието на идеи за структурата на атома и периодичната система на рафинирано еволюира, и тази история има много тайни и открития. Дори и сега положението на някои елементи в системата продължава да се уточни: например, на семействата на лантаниди и актинидите традиционно посочено IIIB група с лутетий (Lu) и лоуренсий (МР), но директно IIIB колона вместо Lu и Lr е позволено да респективно лантан (La ) и актиния (AC).
Само половин век след откриването на учените периодичните право бяхме в състояние да се хвърли светлина върху вътрешната атом устройството и обясни периодичността в свойствата на елементите. Благодарение на напредъка в фундаменталната физика, ние вече знаем, че причината за периодичен закон е слоеста структура на електронните обвивки на атомите.
В естествения серия от химични елементи последователно увеличава заряд Z ядро, и по този начин броя на електроните в атома. Така в електронен облак образува слоеве, които се пълнят последователно от тези електрони. След осем електрони, натрупани върху външния слой (и за първи слой само две), следващият слой започва да се пълни, и тя вече е станала отвън. По този начин, външния слой може да запълни сценарий се повтаря периодично. и като външният слой са валентните електрони, и химичните свойства на съединенията и състава също повтарят периодично с увеличаване Z.
Веднага започва да се пълни с електрони следващия слой в периодичната таблица, се пристъпва към следващия ред, т.е. следващия период. Следователно, броят на периода, в който елементът е равен на броя на слоевете в електрон атом на елемента и съвпада с броя на външен електронен слой. Например, елементите на първия период (Н, He) електрони образуват първия слой; елементи във втория период (Li, Be, В, С, N, О, F, Ne) образуват два слоя, от които е външен секунда; и така нататък.
В една група от елементи, където есента, в която същия брой валентните електрони. За елементи А-валентни групи са само електрони от външния слой, и техният брой се увеличава от един до осем в рамките на всеки период (с изключение на първия). Следователно, А-брой групи (означени с римски цифри), където елементът е равен на броя на електроните на атом във външния слой на елемента. Единственото изключение от това правило е хелий: неговата атом само два електрони във външния слой, но се поставя в група VIIIA, тъй като попълнено външния слой дава свойствата на благороден газ хелий.
Систематизиране елементи Менделеев отблъснати на първо място за състава и свойствата на прости вещества и съединения с кислород и водород. Тези съединения са до голяма степен характеризира с елементите на природата, така че те често се наричат характерните съединения. Това традиционно включват оксиди, хидроксиди и водородни съединения. може да се види в елементите на третия период, броят на валентните електрони, за да се отрази на състава и свойствата на тези съединения (аргон те не образуват и следователно не са включени в таблицата):
Свързани статии
