1. химичната връзка на ковалентна се формира от два електрона с противоположни завъртания, където електронната двойка принадлежи към два атома.
2. връзката на ковалентна е по-силен, толкова повече се припокриват взаимодействие електронни облаци.
При писане структурни формули електронни двойки, които допринасят за комуникация често се опише чрез тирета (вместо точки представляват споделени електрони).
Важна характеристика на енергия от химически връзки. Когато химичното свързване цялостна система енергия (молекули) по-малко енергия компоненти (атоми), т.е. EAB<ЕА+ЕB.
Валентността - това свойство на химичен елемент закрепване атом или замени определен брой атоми на друг елемент. От тази гледна точка, валентността на атома лесният определя от броя на водородните атоми, образуващи химична връзка с него или броя на водородните атоми заместими атом на елемента.
С развитието на квантовата механични представителства на атом валенция от стомана, за да се определи броя на несвоен електрони, участващи в образуването на химичните връзки. Освен несдвоени електрони, валентност атом е също зависи от броя на празен и изцяло запълнена валентност електрони орбитали слой.
Свързването енергия - енергията, която се освобождава по време на образуването на молекули от атоми. Свързването енергия обикновено се изразява в кДж / мол (или ккал / мол). Това е един от най-важните характеристики на химична връзка. По-стабилна система, която съдържа по-малко енергия. Известно е, например, че водородните атоми в молекулата са склонни да се обединят. Това означава, че системата, състояща се от Н2 молекули съдържа по-малко енергия, отколкото система, състояща се от същия брой атоми H, но не са включени в молекулата.
Фиг. 2.1 Зависимост система Е на потенциалната енергия на два водородни атоми на internuclear разстояние R: 1 - образуването на химична връзка; 2 - без образование нея.
Фигура 2.1 показва кривата на мощността, което е характерно за взаимодействие водородни атоми. Конвергентната атоми е съпроводено от освобождаване на енергия, което ще бъде по-голяма, толкова по-припокриването електронните облаци. Въпреки това, при нормални условия, поради отблъскване на Кулон, не е възможно да се постигне синтез на ядрата на двата атома. Така че, на определено разстояние, вместо привличането на атома, ще настъпи тяхното отблъскване. Така разстоянието между атоми r0, което отговаря най-малко на енергията на кривата ще съответства дължина връзка (крива 1). Ако взаимодействащи електрон завъртания на водородни атоми са същите, след това им отблъскване ще се случи (крива 2). Свързващата енергия на атомите за различни диапазони 170-420 кДж / мол (40-100 ккал / мол).
Процесът на преминаване на електрон на по-високо ниво на енергия или подниво (т.е. процес възбуждане или отделянето, което беше споменато по-рано) изисква енергия. Ако възникне химична връзка избор образуване на енергия. За химична връзка е стабилна, е необходимо за увеличаване на енергията на атома поради възбуждане енергия, генерирана е по-малко химична връзка. С други думи, необходимо е, че потреблението на енергия за възбуждане на атомите са били компенсирани за освобождаване на енергия се дължи на образуване на връзка.
химичната връзка на различна от свързващата енергия, се характеризира с дълъг, множество и полярност. За молекули, състоящи се от повече от два атома, значителни количества са ъглите между връзките и полярността на молекулата като цяло.
Разнообразието на комуникация се определя от броя на електронни двойки, свързваща два атома. Така, в етан H3C-СН3 връзка между въглеродните атоми на единична, в етилен H2C = СН2 - двойна, в ацетилен NSºSN - тройна. С увеличаване на комуникация множество увеличава свързващата енергия: енергията на С-С връзка е 339 кДж / мол С = С - 611 кДж / мол и CºC - 833 кДж / мол.
химичната връзка на между атомите се дължи на припокриване на електрона облаци. Ако възникне припокриване по протежение на линия, свързваща ядрата на атомите, такава връзка се нарича сигма връзка (σ-връзка). Това може да се образува в резултат на два S-електроните, S- и р-електроните, рХ два електрона, S и г електрони (например):
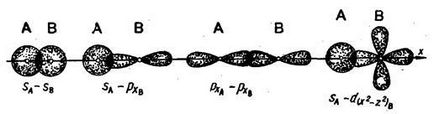
Химично свързване, извършена от една електронна двойка се нарича един. Една единствена връзка - винаги σ-връзка. S-тип орбитали могат да образуват само σ-връзка.
Комуникацията между два атома може да бъде повече от една двойка електрони. Такава връзка се нарича множествена. Пример за образуването на множествена връзка може да бъде азот молекула. В молекула на азот PX-орбитали образуват σ-връзка. В образуването на комуникационните PZ орбити има две области
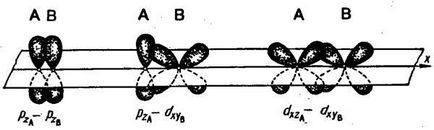
Такава връзка се нарича пи-връзка (π-връзка). Появата π-връзка между два атома се наблюдава само когато те вече са свързани σ-връзка. Вторият π-връзка за да образуват азот молекула PY орбитални атома. При образуването на π-електрон облаци припокриват връзки е по-малко, отколкото в случая на а-връзки. Следователно, π-връзка, обикновено по-малко силен от а-връзки, образувани от същите атомна орбитала.
р орбитали могат да образуват като σ- и я-връзки; в няколко връзки, един от тях непременно σ-връзка :.
По този начин, молекула азот свързва един от трите - σ-връзка и две - π-връзка.
дължина Bond е разстоянието между ядрата на свързани атоми. Дължината на облигации в различни съединения имат стойности на десети от нанометра. С увеличаване на дължини облигации са намалени множество: връзка дължини на N-N. N = N и NºN равно на 0.145; 0.125 и 0.109 пМ (10-9 М), и дължините на връзки С-С, С = С и CºC са съответно 0.154; 0.134 и 0.120 пМ.
Между различни атоми чист ковалентна връзка може да възникне ако elektrootritsaelnost (EO) 1 атоми идентични. Такива молекули elektrosimmetrichny, т.е. "Център на тежестта" на положителните заряди на ядрата и електроните на отрицателните заряди съвпадат в един момент, така че те се наричат неполярни.
Преместването на електронен облак се нарича поляризация. В резултат на това едностранни поляризация центрове на тежестта на положителни и отрицателни заряди в молекулата не съвпадат в един момент, на определено разстояние (L) между тях възниква. Такива молекули са наречени полярни или диполи. и връзката между атоми в тях се нарича полярен.
Polar връзка - един вид ковалентна връзка, която е претърпял незначителни едностранно polyarizatsiyu.Rasstoyanie между "центъра на тежестта" на положителните и отрицателните заряди в молекулата се нарича дължина дипол. Естествено, по-поляризация, по-голяма от дължината на дипол и по-голямата полярността на молекулите. За оценка на полярността на молекулите обикновено са постоянно диполен момент (МР), който е продукт на елементарен електрическия заряд (д) от дължината на дипол (Ь), т.е. ,
Дипол моменти измерени в Debye D (D = 10-18 д. В. U. х cm, тъй като елементарен заряд е 4,810-10 напр. Дължина В. U. дипол и средната стойност е равна на разстоянието между двете ядра атоми, т например гости-. 10-8 cm) или coulometry (Cl х т) (D 1 = 3,33 · 10-30 Kd х т) (електронен заряд от 1.6 х 10-19 кулони умножават по разстоянието между таксите, например, 0 1 пМ, след това Т.т. = 1,6 · 10-19 х 1 х 10-10 = 1,6 · 10-29 m · Cl). постоянни диполни моменти на молекулите имат от нула до 10 D.
В неполярни молекули L = 0 и Т.т. = 0; те нямат диполен момент. В полярни молекули Т.т.> 0 и достига стойности от 3.5 - 4.0 D.
С много голяма разлика в EO атома ясно е едностранно поляризация: електронен облак комуникация максимално изместен към атома с най-големите EO атоми преминават в противоположно заредени йони и йонна молекула появява:
Ковалентна връзка става йонен. Elektroasimmetriya молекули увеличава, се увеличава дължина дипол, диполен момент се увеличава до 10 D.
Общият диполен момент на комплекс молекула може да се счита равна на вектор сумата от диполни моменти на отделните връзки. момент дипол обикновено се счита за насочена от положителната края към отрицателния дипол.
Прогнозира връзка полярност може да бъде чрез относителните EO атома. По-голямата разлика в относителни EO атома, по-изразен полярност ДЕО = 0 - неполярен ковалентна връзка; DEO = 0 - 2, - полярен ковалентна връзка; DEO = 2 - йонна връзка. Правилно да се говори за степента на йонната характер на комуникация, защото комуникацията не се случи 100% йонни. Дори и в йонна връзка Съединените CsF само 89%.
Химично свързване, което възниква в резултат на преминаването на електрони от един атом на друг, наречен йон. и съответните молекули химически съединения - йон. За йонни съединения в твърдо състояние е типично йон кристална решетка. Стопената и се разтваря състояние те провежда електричество, има висока точка на топене и точка на кипене и значително диполен момент.
Ако говорим за свързване на елементи от период от една и съща позиция, след като движение от началото до края на периода, главно йонна характер се заменя с ковалентна. Например, флуориди на втория период LIF, BeF2, CF4, NF3, БЗ 2, F2 ionicity комуникация от литиев флуорид и постепенно отслабва обикновено заместени с ковалентна връзка с молекула на флуор.
Свързани статии
