Organic Chemistry. Молекулярната структура на химични връзки ВЪГЛЕРОДЕН AG
Химичната природа на въглерод, междинен между метали и неметали типични позволява да образува ковалентни връзки с много елементи, често с водород, кислород, азот, халоген, сяра и фосфор. Въглероден образува връзка с висока степен на йонен характер с повече електроположителни метали, но такива материали са високо реактивни и се използват като междинни съединения в синтезата. Въглерод-въглерод връзки са ковалентни по природа и са прости (единични), двойни, тройни и ароматни
(Вж. Молекулната структура).
Ароматни системи. Бензен - предшественик клас ароматни съединения - е уникален стабилност и влиза в химични реакции, различни от реакцията на не-ароматни системи. Има и други ароматни системи, най-често от които имат р-орбитали разположение за да се образува р-връзка, всеки атом на пръстена. Пет-членни пръстенни системи с две конюгирания (т.е., редуващи се с прости) двойни връзки и петата атом, носещи неразделен двойка електрони са също на техните ароматни свойства. По-долу са някои от тези системи са:
Концепцията за ароматност е съставила немски химик Е. на Huckel. Според правилото на Huckel, плосък цикличен спрегнат система с броя на р-електрони равен на 4п + 2, ароматност и стабилна, и същата система с броя на р-електрони 4N - antiaromaticity и нестабилен.
Стабилност на пръстени системи. ъгъл Bond (ъгъл между връзки) в ненапрегнат фрагмент С-С на 109В °, и пръстен, в който се съхранява стойност да бъде по-стабилен, отколкото тези, в които ъглите силно се отклоняват от тази стойност. Напрежението произведени в циклични системи в резултат на нарушаване на ъгли облигации, се нарича Байер - след немски химик А. Bayer, първият предложен тази устойчивост обяснение наситени пръстени. По този начин, в три-членни пръстени, където ъгълът на валентността на само 60V °, силно обтегнати пръстен и лесно разкъсан; някои от техните реакции приличат на реакцията на двойна връзка С = С Четири-членни пръстени са опънати (валентност ъгъл 90В °), но не толкова много. Петчленни пръстени са почти плоски и техните ъгли са равни 108В °; така че те nenapryazhen и стабилна. На шест-членни пръстени, такива като циклохексан, въглеродни атоми не са в една и съща равнина; такива вериги са сгънати, като по този начин намаляване на напрежението пръстен. Пет- и шестчленни пръстени са най-чести. Големи пръстени също са в състояние да намали напрежението от ъгловата нагъване, но в някои от тях (от седем- до дванадесет-членен) водородни атоми са на противоположните страни на пръстена по-близо заедно, така че отблъскване ги прави по-малко стабилно съединение (prelogovskoe напрежение химик от името на Swiss V.Preloga който е открил този ефект).
Тавтомеризъм. Ако молекула или йон може да бъде представена от няколко структури, които се различават един от друг само разпределение електрон, тези структури са наречени резонанс, и резонансни форми не са в равновесие един с друг само от действителното електронната структура на молекулата е нещо между тези крайности. Все пак, има ситуации, в които се движат атомите в молекулата при нормални условия като бързо между е установен на различни молекулни форми на спонтанно равновесие. Това явление се нарича тавтомеризъм. Пример за това е равновесие между кетона и енол (кето-енолна тавтомерия):
Тук двете съединения се различават само в режим на катион водород и електронни двойки (р-във връзка). Равновесието е създаден бързо, но силно благоприятства кето формата. Следователно, с алкохоли с конструкция -C на = С-ОН обикновено е нестабилно и бързо се превръща в кето формата, ако не и някои структурни характеристики, които стабилизират енолна форма, например феноли, които са в прехода към кето формата ще загубят своята ароматен характер:
Тавтомерия конвенционален в молекули, имащи структурата -CH = X или -С = XH, където X - е S, О или N. Така молекула H2C на = C (NH2) -СН3 бързо пренарежда до H3C-C (= NH) - СН3, и имиди RC (ОН) = NH амиди са преподредени в RC (= О) NH2. Тавтомеризъм е обичайно в такива биологично важни хетероциклични системи като барбитурова киселина и свързаните с него съединения:
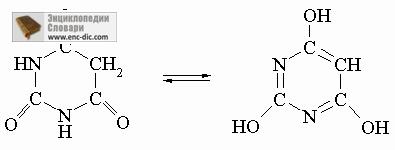
Други бързо равновесие. Има и други бързо равновесие между молекули с подобни структури. Ако за един и същ въглероден атом, са всеки две от групите OH, SH или NH2, съединението обикновено ще нестабилни в сравнение с dvoesvyaznoy форма:
Има случаи, когато това равновесие се измества към дихидрокси съединение. Газообразен формалдехид е СН2 = О структура, но във воден разтвор тя включва молекула вода, намиране на НО-СН2-ОН като преобладаващата форма. Хлоралхидрат Cl3CCH (ОН) 2 е стабилен dihydroxyl форма чрез електронен удар три хлорни атоми.
Б. изомерия
Изомерия въглеродна верига. Молекули, които се различават само в разклонението на въглеродната верига, наречени верижни изомери. Пример вече е дадено - е изомерна двойка п-бутан и изобутан.
Изомерия на функционални групи. Молекули със същия емпиричната формула, но различни функционални групи са функционални изомери, такива като етилов алкохол С2Н5ОН и диметилов етер СН3-О-СН3.
Позиционни изомери. Позиционни изомери имат същите молекулна формула и функционални групи, но позицията на функционалните групи в техните молекули са различни. Така CH3CH2CH2Cl 1-хлоропропан и 2-хлоропропан CH3CHClCH3 са позиционни изомери.
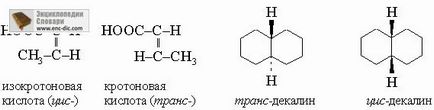
Геометрични изомери. Геометрични изомери се състоят от същите атоми, свързани със същата последователност, но се различават в пространственото подреждане на атомите в сравнение с двойните връзки или пръстени. Цис-транс изомери на олефини и син-анти-оксимни изомери са от този тип.
Помощ за Търсене на двигатели
Свързани статии
