Теорията на химичната структура
Химическа структура е последователността на атома в молекулата на съединението и техните относителни позиции в пространството. Промени в тази последователност води до образуването на нова вещество с нови свойства.
Основните положения на теорията на химична структура:
1. Свойства на материали се определят от неговия качествен и количествен състав и химична структура.
2. soediniyayutsya атома в молекулата, в съответствие с тяхната валентност.
3. атоми и групите атома в молекулата си влияят взаимно, този ефект е отслабена до степента на взаимното им отстраняване.
Теорията на химична структура проектиран AM Butlerov и учениците му през втората половина на ХIХ век.
Химическа връзка. Основни характеристики на химичната връзка
Химическа връзка се нарича взаимодействие задържане атома в молекули и стабилност молекулни причини в определени условия.
Основни характеристики на химичната връзка:
Енергията на свързване (ERU) - необходимото за да се прекъсне комуникацията минимална енергия.
Измерено в електронволта (EV) за една връзка или в кДж / мола за един мол връзки. свързващата енергия е характеристика сила връзка - по-висока енергия на свързване, по-силен е връзка.
дължина връзка (LSV) - разстоянието между ядрата на свързани атоми. Се измерва в нанометра (нанометра) или в ангстрьома (А). Колкото по-кратък връзката, така че е обикновено по-силен.
Saturability връзка - Ако атом образува ограничен брой връзки с други атоми (обикновено не повече от 8) - насищане връзка, ако е безкрайно голяма (над 1000) - ненаситеност.
Ориентация на комуникация - ако в пространството, има определена посока, по протежение на която ефектът на съобщение, съобщението се отнася, ако тези посоки не - nenapravlena.
Енергетиката и дължина връзка характеристика на всяко химично свързване, насищане и посока зависи от вида на комуникация.
ковалентна връзка
Ковалентна връзка - връзката между атоми в общите електронни двойки.
Когато два водородни атома са два случая:
1. малко отблъскващи сили между атомите конвергенция увеличават неопределено (крива 1), енергията на увеличенията на системата и системата не могат да бъдат поддържани.
2. отблъскваща сила заменя привличане сили, които достигат своята максимална, когато разстоянието между ядрата, равно ро (крива 2), енергията на системата в това състояние, минималната и по-малка от общата енергия на първоначалните атоми.
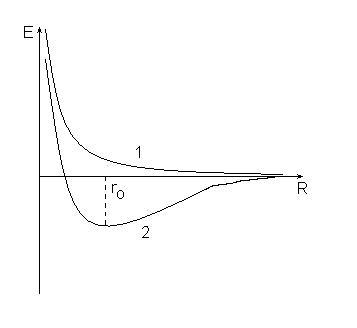
Тази разлика в поведението се причинява от различни стойности на атомните завъртане квантово число за електроните в изходните атоми. Ако електронните спинове са едни и същи, а след това тази крива 1, ако е различно - на 2:
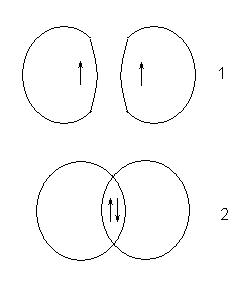
Състояние, което в този случай възниква, съответства на стабилна система, в която ядрата на атомите с област на повишена електронна плътност. Този район компенсира взаимното отблъскване на ядрата и областта на припокриването на орбитали се нарича или споделя електронната двойка.
Това представлява водороден молекула. Тъй като ориентацията на въртене на електроните в водороден атом equiprobable (половината от атомите е електрон спин +1/2, -1/2 половина), образуването на атомен водород от молекулно всички атоми образуват молекулата.
Често този процес е изобразен чрез схемата, означаващ електрони точки:
и общата електронна двойка - функция:
Връзката на ковалентна се формира от два механизма - обмен. когато всеки да участва в образуването връзка осигурява атома общата електронна двойка на един електрон (А) и донор-акцептор. когато донорът дава електронна двойка, а акцептор - без орбитален (В). Фигурата показва схемата на тези механизми и правилното им реакция в реално производство:
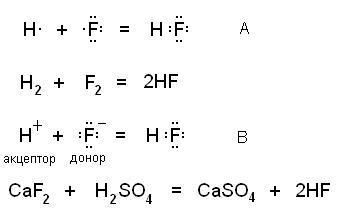
Получената молекула нищо един от друг не се различават.
Полярни и неполярни ковалентна връзка
Според симетрията на такса за разпределение ковалентни връзки са разделени в полярен и неполярен.
Ако общата електронна двойка (областта на припокриване на орбитали), разположени симетрично по отношение на свързаните ядра, наречен ковалентна връзка неполярен ако пристрастен към един от сърцевините - полярен ковалентна.
Неполярен ковалентна връзка възниква между атомите на същия елемент, ако това се дължи на симетрия на връзката за разпределяне на шихтата не диполен момент. Примери на неполярни молекули с ковалентна връзка: Н2. O2. F2, Cl2. N2. AG2.
Ако участва в свързване на атомите на различни Електроотрицателност има полярен ковалентна връзка. Общият електронна двойка се измества към атом, с по-голяма Електроотрицателност, полученият асиметрия в разпределението на такси води до появата на връзка дипол momenta.Chasto компенсира електронна двойка показва стрелка, например:
Символ показва двуполюсни такси, които могат да бъдат по-малко от таксата за електрон, но съществуват само заедно.
Електроотрицателност въглероден атом зависи от хибридизация в таблицата за сравнение, относителната електроотрицателност на някои въглеродни атоми и хибридни състояния:
- и -връзките
- -връзките и разграничени от симетрия орбитали припокриват.
Ако линията, свързваща свързан сърцевината атома преминава през участъка на припокриване на орбитали се нарича връзка-връзка, ако припокриващия участък се намира от външната страна на линията - -връзките.
-връзки са образувани с припокриващи S-S орбитали атоми (А), р-р орбитали (В), S-р орбитали (С) и хибридни орбитали:
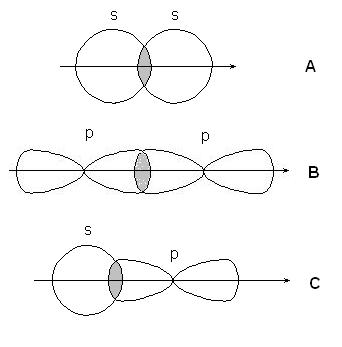
-комуникация - с припокриващи пп орбитали:
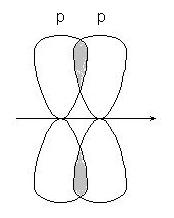
или р-орбитали г:
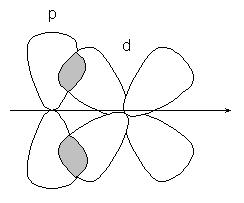
-връзка е по-малко силен, отколкото-връзка, електроните са лесно податливи на външно влияние. В съединения с множество връзки, само една от връзките е -cvyazyu образува чрез припокриване S, Р или хибридни орбитали, а останалите - -връзките образува чрез припокриване на не-хибридизира р - орбитите атоми, например двойни връзка, образувана хибридни орбитали (-връзките) и не участва в хибридизация р орбитали (-връзките):
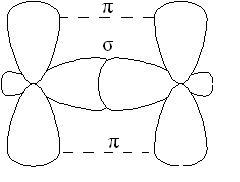
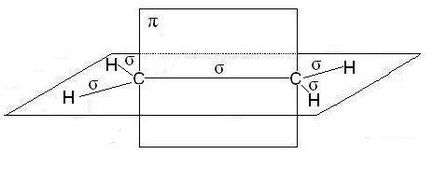
В молекули на алкени, по-специално етилен, въглеродните атоми в dvoynoysvyazi са в SP 2 хибридизация, всички С-Н ЕО-C -връзките лежат в една равнина, се припокриват nonhybrid р орбитали атоми uglerodaproiskhodit в равнина, перпендикулярна на равнината на -връзките. Понякога това ploskostnazyvayut самолет -връзките:
В случай на тройната връзка, като молекули на алкини, като ацетилен, въглеродни атоми са в комуникация SP-хибридизация Две -връзките образува припокриващи nonhybrid р орбитали на въглеродни атоми (две от всеки) лежат в две взаимно перпендикулярни равнини:
В таблицата са посочени основните характеристики на връзките между въглеродните атоми:
водородна връзка
Връзката на водород е оформен механизъм донор-акцептор между водородните атоми, прикрепени към електроотрицателна атом и атом, имащ свободна двойка електрони, например:
Водород, свързан с въглероден атом е в състояние на водородно свързване.
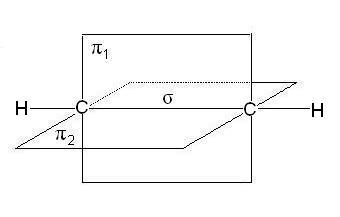
енергия водородна връзка е ниско (10-40 кДж / мола), то все пак е до голяма степен влияе на физичните и химичните свойства на съединенията. Съединение с междумолекулни водородни връзки са много по-висока точка на кипене от съединенията със същото молекулно тегло, но не са свързани с водородни връзки. Например, температурата на кипене на етанол (78,3 ° С) е много по-висока от точката на кипене на диметилов етер (24 ° С). Обратно, вътрешномолекулни водородни връзки може да доведе до понижаване на точката на кипене. Например о-салицилалдехид (А, вътрешномолекулни водородни връзки) е по-голяма променливост в сравнение с р - хидроксибензалдехид (B междумолекулна водородна връзка):
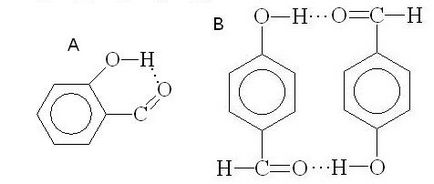
Образуването на водородни връзки обяснява разтворимостта на много органични съединения в полярни разтворители. Например, нисши алкохоли хидратация възниква във воден разтвор:
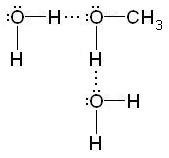
Водородни връзки играят важна роля в образуването на struktrury протеини пространствени, въглехидрати, нуклеинови киселини.
Свързани статии
