0 (т) <0, в правой части выражения (1.90) R> 0, T> 0, следователно първата производна на логаритъм на равновесната константа на температура е отрицателен
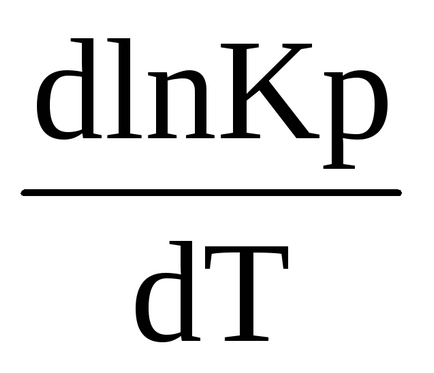
За ендотермичен процес Δr H 0 (т)> 0, производното на логаритъм на равновесната константа на температурата е положително (
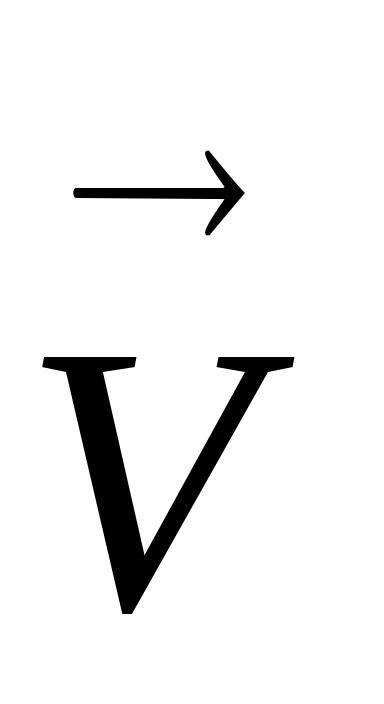
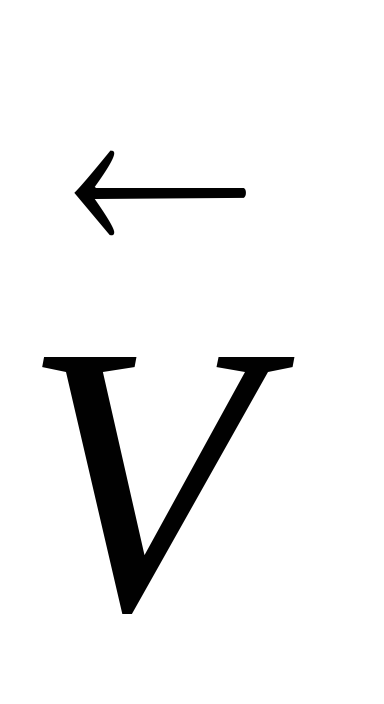
Според Льо Шателие принцип чрез изменение на концентрацията на един от участниците на равновесие се измества в посока на компенсаторни промени в реакцията, т.е. да, чрез увеличаване на концентрацията на един от изходните материали - от дясната страна, а увеличаване на концентрацията на един от реакционните продукти - наляво. Ако обратима реакция, включваща газообразни вещества, промяна на налягането, еднакво и едновременно промените всички тяхната концентрация. И промяна на скоростта на процесите, и поради това може да се случи и изместване химически равновесие. Например, увеличаване на налягането (в сравнение с равновесие) на СаСО3 система (К)
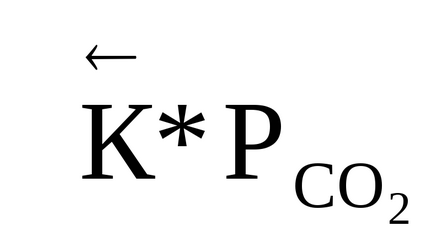
За системата 4HCl + O2
И така, в съответствие с принципа на Le Шателие когато се увеличава налягането, равновесието измества към образуване на по-малък брой молове на газообразни вещества в газовата смес, и по този начин за намаляване на налягането на системата.
Обратно, когато външно въздействие, което води до спад на налягането, равновесието се измества към образуването на по-голям брой молове на газообразни вещества, които предизвикват увеличаване на налягането в системата и да се противопоставят на ефекта, произведени от.
Принцип на Льо Шателие-Браун е от голямо практическо значение. Въз основа на това ние можем да избираме условията на химически взаимодействия, които осигуряват максимален добив на продуктите на реакцията.
Свързани статии
