Друг важен пример е отклонението от образуване на равновесие при фазовата трансформация на метастабилни фази. Така наречената неравновесна фаза, които са в някои случаи:
а) на преходния период между началния и фазата на равновесие,
б) фаза стабилен при определени съотношения на налягане, температура и концентрация.
В диаграмите на фаза равновесие ravnovesiymetastabilnye изобразени с прекъснати линии.
Метастабилни фази образувани чрез кристализация на елементарни вещества и двоични сплави със значителни преохлажда стопилки (разтвори), и температура и концентрация диапазон, в който тези фази са метастабилни, има различна дължина. Изобарни-изотермично потенциал на метастабилната фаза е по-малко от това на оригинала, но по-голяма от фазата на равновесие, така че превръщането на метастабилната фаза в равновесие изисква определена активиране на енергия, в отсъствието на метастабилната фаза може да съществува за неопределено време.
Образуването на метастабилната фаза - явление, често се наблюдава и широко използвани и трансформации в твърдо състояние. Това включва основно на образуването на свръхнаситен твърд разтвор, ако тяхното разлагане се осъществява при ниски температури, когато дифузията и образуването на фазите на равновесие съответно възпрепятствано.
Има всички основания да се смята, че наблюдаваното в силно легирани полупроводници несъответствие на концентрацията на електрически активни примеси и неговите горни (химически) концентрация (политропен примеси) в някои случаи е резултат от началните етапи на разлагане на твърд разтвор, в който процес, включващ примеси, образувани метастабилна фаза.
За описание на схемите метастабилната фаза с помощта на специални фаза равновесие метастабилни фази - т.нар метастабилна диаграмата. Области на Metastability и метастабилни химични съединения на такива диаграми показват, пунктираната линия. Въпросът за прилагането на правилото за фазата на метастабилност диаграмата е спорно. Фиг. 9.3 показва равновесната фаза диаграма на системи С и Co-Ni-C и метастабилни диаграми на тези системи.
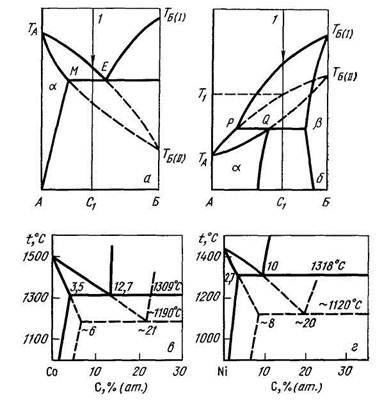
Фиг. 9.3. Метастабилна диаграма (плътна линия - стабилна, грундира - метастабилна равновесие): и - възможно метастабилна равновесие диаграма тип евтектична; б - възможно метастабилна равновесие диаграма peritectic тип; в - метастабилна система диаграма СО-С; R - метастабилна диаграма Ni-C система.
Metastability количество, определено чрез разликата между енергиите на метастабилната фаза и смес от стабилни фази. При много високи скорости на охлаждане (към февруари 10 - 10 10) K / и на преохладени стопилки (разтвори) под определена температура може да се получи твърдо вещество метастабилна фаза не само в кристална но в аморфно състояние (когато фаза е за къси разстояния и няма за далечни разстояния по подреждането на атомите). Сплавите в аморфно състояние могат да бъдат получени не само по време на кристализацията от течната фаза, но също и по време на отлагането от газовата фаза. За в аморфно състояние фази с ковалентно свързване изисква по-малко скорост на охлаждане в сравнение с фазите с метална връзка.
Знаейки диаграма фаза равновесие е необходимо също така при избора състави от течната фаза и температурните условия на кристализация. Това е особено важно при получаването на кристали от съединения. Да разгледаме този пример в производството на единични кристали от тях дърпа от течната фаза чрез метода на Czochralski.
Кристализация се появява по-зародишен кристал в контакт с повърхността на течността се стопи на преохлажда # 8710; T под температурата на втечняване. Това хипотермия се поддържа по време на процеса на кристализация. Както кристализация на нови слоеве на твърдата фаза на зародишен кристал извади от течната фаза. Състав кристализация на твърдата фаза се определя от фаза диаграма на равновесие, ако се поддържа по време на условията на процеса чертеж близост до равновесие (скорост на кристализация е малък, широко разпространени дифузионни процеси в твърда и течна фаза, т.е. # 8710; T → 0).
Конгруентно топене съединение, например врата и GA2 Te3 (вж. Фиг. 8.2 а. L. 8) може да бъде получено от течната фаза на същия състав като този на съединението. Те могат да бъдат получени чрез кристализация от стопилка и малко по-различен състав: например, съединение порта - стопи състав X1 на кристализация при температура в границите между 1100 и 1019 К. Въпреки това, следва да се отбележи, че ако съединението е определена хомогенност обхват, тогава на извади кристал няма да има стехиометричен състав, и ще бъде твърд лимит разтвор концентрация на базата на съединението, температурата на равновесие кристализация.
Неподходящ съединение топене не може да се получи от течната фаза на същия състав. Например, на фиг. 8,2 литра. 8 показва, че на течна фаза, съответстващ на състава в GaTe3 свръхохлаждане долу ликвидус линията на твърда фаза ще кристализира състав GA2 Te3. вместо GaTe3. За по време на кристализацията от течната фаза разпределени, конгруентно топене съединение GaTe3. състав на течната фаза трябва да бъде в концентрация от Х2 да X3. и кристализация трябва да се провежда при температура в границите между Т3 (
760 К), и Т4 (709 К). Обсъдено по-горе кристализация incongruently топене съединение се нарича от разтвора чрез кристализация.
Свързани статии
