Говорейки по-строго, относителният местоположението на поднива се дължи не толкова от тяхната по-голяма или по-малко енергия, като минимално изискване за общата енергия на атома.
Разпределението на атомна орбитала на електрони се случи, тъй като орбитален с най-ниска енергия (минимум принципа енергия), т.е. Той е разположен на електрона най-близо до ядрото орбита. Това означава, че първите подслоеве са запълнени с електрони, за които е сведена до минимум на сумата от стойностите на номерата на квантовата (п + L). Тъй като електронна енергия в 4s-подниво по-малък от електронна енергия, който се намира на 3--подниво. Следователно електрони пълнене поднива в следния ред: 1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <5d
4е <6p <7s <6d
Въз основа на това изискване, минималната енергия се постига по-голямата част от атомите, когато те са пълни поднива в последователността, показана по-горе. Но има и изключения, които можете да намерите в таблиците "Електронно конфигурационни елементи", но тези изключения са редки, за да бъдат взети предвид при определянето на химичните свойства на елемента.
хром атом не електронна конфигурация 3d 2 4s 4. 1 4s 3d 5. Това е пример за това как условията на стабилизиране с паралелна електрон завъртания малка разлика преобладава над енергийните състояния на поднива 3d и 4s (правило Hund е), е енергично благоприятни за състоянията г-г подслой е 5 и 10 г. енергия диаграма на валентните поднива на атоми на хром и мед са показани на ris.2.1.1.
Такава преход от един електрон от подниво на S-г-подслой се появява дори и при 8 елементи: Cu, Nb, Mo, Ru, Ag, Pt, Au. В преход атом Pd два S-електроните на г-подслой: Pd 5s 0 10 4d.
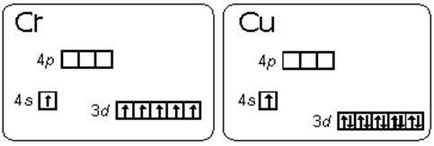
Ris.2.1.1. Енергийният диаграма на валентните поднива на атоми на хром и мед
Правила за попълване на електронен слой:
1. На първо място, ние разберете колко много електрони атом съдържа елементите на интереси. За тази цел е достатъчно да се знае заряда на ядрото, което винаги е равен на поредния номер на елемента в периодичната таблица на Менделеев. номер на последователност (брой протони в ядрото) и точно равен на броя на електроните около атома.
2. В съответствие попълнете орбитали започващи с S-1 орбиталните електрони наличните, като се вземе предвид принципът на минималната енергия. По този начин не е възможно да има на всеки орбитални повече от два електрона с противоположни завъртания (обикновено Pauli).
3. Добави формула електронен елемент.
Atom - е сложна, динамична стабилност Микро взаимодействие частици: протони р +. неутрони п 0 и електрони, д -.
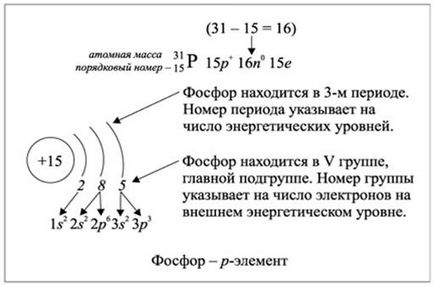
Ris.2.1.2. Попълване на енергийните нива на електроните на фосфор елемент
Електронната структура на водородния атом (Z = 1) може да бъде представена както следва:
+1 Н 1s 1. п = 1 ↑, където кутията квантовата (атомна орбитална) е означен като линия или квадрат, и електроните - под формата на стрелки.
Всеки атом последващо химичен елемент в периодичната таблица е много-електронна атом.
Литиево атом, както и водород и хелий, има електронната структура на S-елемент, като последно електрон на литиев атом "седи" на S-подниво:
борен атом появява първият електронен в р-състояние:
Записване електронен формула по-лесно да се покаже конкретен пример. Да предположим, че трябва да се намери формула електронен елемент на номера на последователност 7. В атом на елемент 7 трябва да електрони. Напълнете орбитална семейството електрони, като се започне от 1-ци-орбитални дъното.
Така че, 2 електрони ще бъдат разположени на 1-ци-орбитални, електрона 2 повече - на 2s-орбитални, електрона, а останалите 3 могат да бъдат настанени в три 2P орбити.
Електронни формула елемент с пореден номер 7 (този елемент е азот като символът "N") е както следва:
Да разгледаме правила за действие в Gunda например азотен атом: N 1s 2s 2 2 2p 3. На втория електронен ниво има три идентични р-орбитали: 2px, 2py, 2pz. Електроните ги обитават, така че всеки един от тези р-орбитали ще бъде един електрон. Те отдават това на факта, че електроните в съседните клетки малко отблъскват взаимно, както като заредени частици. Получената електронен контакт формула азота носи важна информация: второ ниво (външна) Електронната азот е запълнена с електрони не трябва да завърши (в нейните 3 + 2 = 5 валентните електрони) и изпълват напълно липсват три електрони.
Външно ниво нарича атом най-отдалечената от средния слой, който има валентност електрони. Тя е тази обвивка е в контакт при сблъсък с външните слоеве на други атоми в химични реакции. При взаимодействие с друг азотен атом може да приеме електрон до 3 допълнителни си външен слой. Където азотният атом ще получи пълен, т.е. максимално попълнено външната ниво електрон, който ще се намира 8 електрони.
Пълна ниво енергично благоприятни напредък, така че азотният атом трябва лесно да реагира с друг атом, който може да му осигури 3 допълнителен електрон, за да завърши на външния слой.
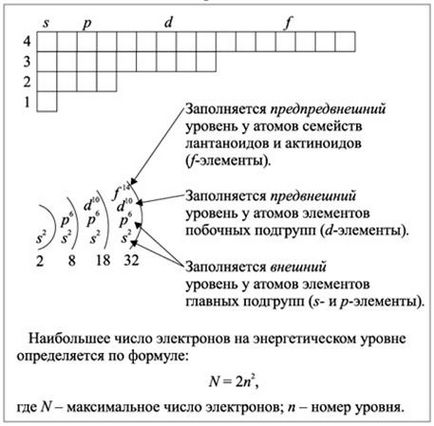
Ris.2.1.3. Пълнене на енергийните нива в S-, р-, D- и F- елементи на електрони
Свързани статии
