Кулон привличане сила, произтичащи от взаимодействието на заредени йони и действат еднакво силни във всички посоки. В резултат на тази конструкция на йоните в пространството се подредени по определен начин, като образува йонна кристална решетка. Вещества с йонен KR при нормални условия са в кристално състояние, те имат висока температура на топене и температурата на кипене.
Метали и сплави кристализират под формата на метални решетки. Възли в метална решетка са заети от положителни йони на метали. Валентен електрон отделени от металните атоми и останалите възли в йони кристалната решетка, повече или по-малко свободно да се движат в пространството между катионите и причиняват електропроводимостта на метали. Между йони и свободни електрони възникне електростатични взаимодействия, които са причина за метален връзката.
метален връзка има сходство с двата йонни (образувани поради взаимодействието между заредени частици: електрони и йони) и ковалентна (настъпва социализация електрони, но за разлика от ковалентна връзка, където електрони са локализирани около някои атоми, електрони в метали са общи за всички кристал). Безплатни електрони понякога наричани електронен газ.
Катиони в метални решетки имат не транслационно движение и осцилира около положението на възловите точки на решетка. Амплитудата на тези вибрации се увеличава с повишаване на температурата и, когато металната решетка на температурата на топене свива. Ниски метали топене обикновено увеличава с броя на валентните електрони в техните атоми.
Смеси от две или повече отделни метали наречените сплави. Сплавите могат да присъстват в малки количества и някои неметали (въглерод, сяра, силиций). Един общ метод е да се получи обща нагряване на сплавите на техните компоненти до пълно разтопяване на сместа. Въпреки това, някои метали не се сливат помежду си във всяко едно отношение.
Метални сплави могат да бъдат класифицирани както следва: твърди интерстициални разтвори (Част интерстициални кухини на решетката са заети от атоми на други елементи, като например въглеродни атома в желязо-желязо и стомана); заместители твърди разтвори (основен материал порциите атома заместени с атоми на спойката на примес елемент калай, 64 части калай и 36-олово); смес от кристали на отделните метали; смес от кристали intermetalicheskih съединения (кондензирани метали образуват химически съединения, присъстващи в бронз Cu3 Sn съединение)
Ван дер Ваалс сили - междумолекулни сили (и interatomic) взаимодействие с енергия на 10 - 20 кДж / мол. Този термин първоначално се отнася до всички такива сили в съвременната наука като обикновено се прилагат към силите, възникващи в поляризацията на молекулите и формирането на диполи. OtkrytyYa. Г. ван дер Ваалс през 1869.
Ван дер Ваалс принуждава interatomic инертни газове причиняват възможността на агрегат състояния на инертни газове (газ, течност, твърди тела).
За ван дер Ваалс сили на взаимодействие между диполи се (индуцирана и постоянен). Името произлиза от факта, че тези сили да доведат до корекции на вътрешното налягане на уравнението на състоянието на един реален газ сили ван дер Ваалс. Тези взаимодействия и водородни връзки, определяне на образуването на пространствената структура на биологични макромолекули.
Ван дер Ваалсови сили възникват между частицата (макроскопична частица или наночастици) и молекула или между две частици
15. Методът от валентните връзки. Идеята за хибридизация на атомни орбитали. Геометрията на многоатомни молекули: модел на Gillespie.
Метод валентна връзка (MFR) се нарича по друг начин теория на локализирани електронни двойки, тъй като методът се основава на предположението, че химичната връзка между два атома се осъществява чрез една или повече електронни двойки, които са локализирани предимно между тях. За разлика от ММО, която е просто химична връзка може да е двойна и мулти-център, в МВС е винаги две електрон две център и да бъде сигурен. Броят на елементарни химични връзки, които са способни да образуват атом или йон, е равна на неговата валентност. Точно както в MMO, в химически връзки участват валентните електрони. Функцията вълна описва състоянието на електроните, които връзката, се нарича локализиран орбитален (LO).
Имайте предвид, че електрони са описани от LR, съгласно принципа на Паули изключване трябва да са противоположно насочени назад, т.е. в MVS всички завъртания са сдвоени и всички молекули трябва да бъде диамагнитната. Следователно принцип MFR може да обясни магнитните свойства на молекулите.
Независимо от това, на принципа на локализирани облигации има няколко важни предимства, едно от които - изключителната му яснота. MIF достатъчно добре, например, прогнозира възможните валентните атоми и геометрията на получената молекула. Последното се дължи на т.нар хибридизацията AO. Тя е въведена, за да се обясни факта, че две електронни две център химическите връзки, образувани за сметка на АД в различни енергийни държави имат една и съща енергия. Така бъде * (2s 1p 1 1), В * (2s 2p 2 1), C * (2s 2p 1 3) е образувана от S - и р орбитали, съответно, два, три или четири връзки и следователно един от тях Тя трябва да бъде по-силен от другия. Въпреки това, опитът показва, че в BeH2. BCl3. CH4 всички връзки са равни. В ъгъл BeH2 връзка е 180 °, при BCl3 - 120 °, а на CH4 - 109 ° 28 '.
Съгласно концепцията на хибридизацията, химични връзки се образуват смесени - хибридни орбитали (GO), който е линейна комбинация от AO атом (и - и р AOS бъде, В, С), имат същата енергия и образуват специфична ориентация в пространството (симетрия ). Тъй като S - и р орбитали дават dvesp тата под ъгъл 180 ° една спрямо друга.
Хибридни орбитали и геометрия на молекули
Gillespie модел се основава на предположението, че комуникацията се осъществява чрез двойка електрони, и геометрична структура на молекули / йони се определя от общия брой на електронни двойки около централната атом. В този случай, се прилагат следните правила:
· Електронно двойка неразделен разделени и са разположени около централната атом, така че тяхната отблъскване е сведена до минимум, т.е. при максимално разстояние една от друга
· Lone електронна двойка заема по-голям обем от разделен
· Том заета от свързване електрон двойката по-малко от olshe електроотрицателна атом свързан към централната
· Две двойки електрони от двойни връзки заема по-голям обем от една двойка от единична връзка
Недостатъци Гилеспи модел
· D- неприложимостта за повечето съединения, S-елементи
· Неприложимост до съединения с значителна част от йонен характер на комуникация
· Невъзможността да се предскаже геометрията на молекули / йони на инертен неразделен електронна двойка
16. Метод на молекулни орбитали. Основни понятия. Две център два електронни молекулни орбитали. Енергийните диаграми хомоядрени двуатомни молекули, образувани от елементи на 1-ви и 2-ри рамки. Магнитни свойства. Корелацията между комуникационни процедури и йонизационна енергия. Обикновено енергийни диаграми хетероядрена молекули (CO, СН, LiH, Н 2О).
Методът MOD, да предположим, че в молекулата като атом, може да се конструира набор от разрешени дискретни енергийните нива и вълна функции, съответстващи на тях (молекулни орбитали), описващи поведението на електрона в молекулата. На всяко ниво на енергия може да се намира на не повече от два електрона. За конструиране на функциите на вълната MO често използват атомна орбитала (AO), всеки описва ил MO като линейна комбинация от AO (LCAO МО).
Изборът на такъв представяне МО физически доста ясна: в близост до всяка проба молекула електрон поведение трябва да бъде подобна на поведението е описано в атом и атомът, съответстваща на тази SA. В този случай, приблизителното решение (тъй като молекулите на уравнението на Шрьодингер може да бъде решен само приблизително!), Поне в тези области ще бъде доста вярна. В района между ядрата на отбраната ще бъде описан от суперпозиция от АО. Проблемът с намирането на МО вълнови функции като по този начин се свежда до намиране на коефициентите. Освен това, необходимо е да се определи подходящото енергия за всяка МО.
17. водород молекула и методи за неговото описание. Методът на валентна връзка и молекулно орбитален метод. лечение LCAO. Припокриването на атомни орбитали, Sigma и пи-връзка, (множество) връзка ред. Химично свързване в Н2 частици. H2 - H2 + и от позицията на Министерството на отбраната и въоръжените сили на методи.
18. химична връзка в хомоядрени двуатомни молекули елементи на втория период от точкови MO и VB методи. MO схема за молекули, начало и край на втория период. Промяна на реда на връзка, свързваща енергия, дължина връзка в прехода от LI2 да NE2. Характеристики на В2 и O2 молекули. Силата на връзка в молекулата N2
19. хетероядрена двуатомен молекула елементи на втория период. MO схема за HF, CO, CN, НА. Слънце и орбитална метод хибридизация. Валентно състояние на атома. Видове хибридизация и пространствената структура на молекулите от Gillespie.
20. ковалентни връзки в многоатомни молекули. Донор-акцептор взаимодействие. Локализиран и делокализирана връзка. Три център облигации. Ориентация и насищане химически ковалентна връзка. VSEPR теория валентността обвивка и пространствена структура на молекулите
Донор-акцептор взаимодействие - прехвърляне заряд между донорни и акцепторни молекули без образуване на химични връзки между тях (механизъм преобразуване); или прехвърляне на неразделен електронна двойка на донора до акцептор, в резултат на образуването на връзка (донор-акцептор механизъм).
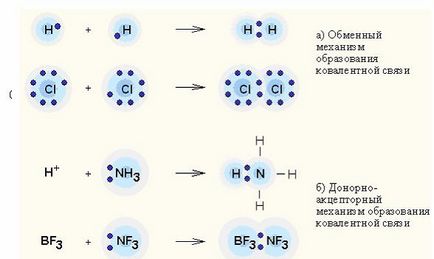
Ковалентна връзка - най-честата форма на химичното свързване, причинен социализация електронна двойка чрез механизма обмен. когато всяка от взаимодействащи атоми доставя един електрон или механизъм донор-акцептор. ако предава електрон двойка на общото използване на един атом (донор) към друг атом (акцептор).
Делокализирани връзка - връзка електронна двойка, която се разпространява чрез няколко (повече от 2) и yadr атома (металик сходство връзка).
Свързаното ковалентна могат да бъдат локализирани и делокализирани. Наречен локализиран връзка, която електрони ефективно разделени между две ядра свързващи атоми. Ако свързващите електрони се поделя между повече от две ядра, се говори за делокализираният облигации.
Делокализирани връзка - е ковалентна връзка, молекулни орбитали който обхваща повече от два атома.
Делокализирани връзки в повечето случаи са я-облигации. Те са характерни за конюгирани системи. В тези siste- макс извършва специален вид взаимно влияние атоми - спрежение.
КонЬгирането (мезо, от гръцки Mesos -. Средна) - това привеждане в съответствие на връзките и такси в реално молекула (частица) в сравнение с идеална, но нито един от съществуващите структура.
Участие в конюгиране делокализирани р орбитали могат да принадлежат към две или пи-връзки и повече или π-връзка и един атом с р орбитала. Съответно се прави разлика π, π-конюгиране и # 961 ;, π-конюгиране. конюгиране система може да бъде отворен или затворен и може да включва не само въглеродни атоми, но също хетероатоми.
Три-център две-електронна връзка - един от възможните електрон дефицитни връзки. Характеризиращ се с това, че двойката на валентните електрони локализиран в пространството непосредствено три атома (следователно терминът "електрон дефицитни" - "нормална" случай е два център две-електронна връзка). Общо описание на механизма на електрони връзки е дадено по отношение на теорията на молекулни орбитали (модел "необвързващи" орбитали).
Най-голям принос за развитието на теория trohtsentrovyh два електронни облигации се извършва в изследването на борохидриди и органоборни съединения, в които такова свързване се осъществява много често (например диборан).
Може да има друг електрон дефицитни комуникация с друг съотношение на електроните валентните и свързаните атоми. Такова свързване често се прилагат в органометално съединение.
VSEPR теория валентни орбитали (OEPVO) - един от подходите в областта на химията, необходими, за да обясни и предскаже geometriimolekul. Според тази теория, молекулата винаги ще бъде под формата, в която външната електронна двойка отблъскване на е минимална (минимум принцип на енергия).
Характерни свойства на ковалентна връзка, - фокус, насищане, полярност, поляризуемост - определяне на химическите и физическите свойства на съединенията.
Ориентация на комуникация поради молекулярната структура на веществото и формата на молекулата геометрична. Ъглите между двете връзки се наричат валентност.
Saturation - способността на ограничен брой атоми за образуване на ковалентни връзки. Броят на връзки, образувани с атом, е ограничен до външните атомна орбитала.
Полярността на връзката поради неравномерното разпределение на електронната плътност поради разликата в електроотрицателни атоми. На тази основа ковалентни връзки подразделят на неполярен и полярен (неполярен - двуатомен молекула се състои от същите атоми (Н2 Cl2 N2) и електрон облаци всеки атом са разпределени симетрично по отношение на тези атоми .. полярна - двуатомен молекула се състои от атоми на различни химични елементи, а общият електронен облак движи към един от атомите, при което се образува асиметричен разпределение на електрически заряд в молекулата, генериране на диполен момент на молекулата).
Съобщението на поляризуемост изразява в изместване на електроните под въздействието на външно електрическо поле, включително други реактивни частици. В поляризуемост на мобилността на електрон се определя. Поляритета и поляризуемост на ковалентни връзки определя реактивността на молекули върху полярни реагенти.
21. Типовете химична връзка и кристали. Видове кристални решетки. Основи на теорията на групата. Комуникация в метали, полупроводници и диелектрици. Дефектите на кристалната решетка. Твърдите разтвори. Йонна връзка. Взаимодействие на йони в кристалната решетка. Енергията на йонната кристалната решетка, размерът на ефект и йонни такси
Band теория - описанието на движението на електрони в кристали, е в основата на съвременната теория на метали, полупроводници и диелектрици.
Големината на забранената зона е ключов променлива и определя електрически и оптични свойства на материала.
Проводници - материали, от които групата проводимост и валентните ленти припокриват за да се образува една зона - лента проводимост (така електрон може да се движи свободно между тях).
Изолатори - материали, от които площта не е покрит. С цел да се прехвърли на електрон от валентната зона на проводимата зона са необходими нива на енергия, така че едва ли диелектрик проводим.
Полупроводници - материалите, от които не се припокриват зона. С цел да се прехвърли на електрон от валентната зона на проводимата зона изисква по-малко енергия, отколкото тази на диелектрични, толкова чисти полупроводници слаб ток преминава.
Молекулно · - в молекулната решетка на молекулата е, че е присъщо на решетка съединение с ковалентна връзка. тук не включва метали (с изключение на Н, Si)? всички органични съединения H2SO4? HCl
· Атомните -, възловите точки атоми са диамант, графит - не разтворим във вода огнеупорен. не разтворим
· Ion - в възли разположени положителни и отрицателни йони, които са свързани една с друга солева йони електрически привличане. основа на алкален. Трайност, висока точка на топене. не са летливи. Много водоразтворим
· Метал - в възли разположени метални атоми, термичната проводимост
Свързани статии
