Хомоядрени двуатомни молекули [c.49]
Молекули Oj, NJ и I2, които се състоят от атоми на само един вид се наричат хомоядрени. В контраст, такива молекули. като НС1, СО или HI, наречен хетероядрена. Нека циркулира гореописания прост подход за лечение на молекули от Н и Н й, въз основа на теорията на молекулни орбитали. на хомоядрени двуатомни молекули елементи на втория период. Някои от тези молекули. например Nj ОВ и Fj, са стабилни при нормални условия. Други, като С или Lij, открити само при високи температури. voobshe докато други не съществуват. Как да се обясни тези факти теорията на молекулните орбитали [c.520]
Когато взаимодействащи атоми образуват хомоядрени молекули (атома чрез взаимодействие на един елемент) или хетероядрена (с взаимодействието на атоми на различни елементи). [C.17]
Пълнене орбитали с електрони се извършва по същия начин, както в случая на хомоядрени молекули. ДА молекула изоелектронен С2 разлика се състои главно между тях по начин, който нива и [c.538]
Лесно е да се види, че тези комбинации са линейно независими. Разглеждане на комбинация XI и 2. Както се вижда от фиг. 4.3, полученият функцията изглежда модифициран р-AO с една голяма и една малка лопатки на X1 и / 2-голям остриета са насочени по оста 2 в противоположни посоки. Предполагаме хомоядрени молекула под внимание, така че на Huckel двете 2s AOS имат една и съща Кулон инвариант [c.172]
Електронни структура хомоядрени двуатомни молекули се определя от умствено процеса на пълнене валентните електрони на молекулни орбитали. от и завършва с. с цел увеличаване на енергията. Така, че е възможно да се установи, например, че молекулата N2 има електронна конфигурация СС (а) (един а-връзка), и молекула N2 има конфигурация QA (а,) (V) (вод. Y) (а,) с три ефективно връзки (един а-облигации и двата р-връзки). Ефективният брой на свързващите електрони разделени от 2 дава конвенционалните процедури за комуникация. Например, редът на N2 молекули връзка 1, и N3 е реда връзка 3. С увеличаване на реда на комуникация в предварително определена комуникационна система хомоядрени двуатомен намалява неговата дължина и свързващата енергия увеличава. [C.544]
Наборът от възможни ротационни състояния зависи от това дали молекулата хомоядрени N. О) или хетероядрена (НС1). Ето защо, ние смятаме два случая поотделно. [C.246]
Единственото възможно колебанията в двуатомен молекула е атомна движение по оста, свързваща двете ядра. Ако хомоядрени молекула (O2, I2, и така нататък. Г.), Очевидно е, че центровете на положителните и отрицателните заряди във всички фази на трептенията са едни и същи и момента, в който дипол винаги е нула. Колебанията такива молекули не са придружени от абсорбцията на инфрачервени лъчи и се наричат неактивни в инфрачервения спектър. От друга страна, ако атомите в молекулата са различни (НС1, CO, и т. Д), Електронната разпределението на колебание варира валентна връзка. В този случай, центровете на положителните и отрицателните заряди не винаги съвпадат, което води до диполен момент промени. Тези вибрации се наричат активни. Те могат да взаимодействат с електромагнитно лъчение, пот [C.13]
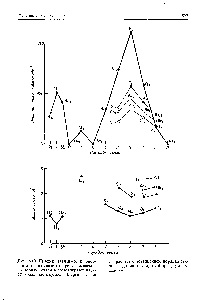
Фиг. 3. дезинтегриращи (а) и свързване (б) функциите на вълната на хомоядрени двуатомен молекула

Изследване на електронната структура на общата форма на хетеронуклеарна двуатомни молекули AB извършва точно както беше направено за хомоядрени молекули. И в двата случая са сходни орбиталните енергийни диаграми. с единствената разлика, че орбиталните нива повече електроотрицателна атом разположен по-дълбоко от по-малко електроотрицателна атом (фиг. 12-13). Следователно, свързващи молекулни орбитали съдържат преобладаващо участие повече електроотрицателна атом. и antibonding орбитали преобладаваща [c.537]
Защо орбитални изображения за хетеронуклеарна двуатомен молекула на фиг. 12-14 различават от съответните изображението за хомоядрени двуатомни молекули на фиг. 12-7 [c.546]
Какво се наричат двуатомни молекули хомоядрени и хетероядрена какво [c.545]
В повечето случаи, основната срока на двуатомни молекули - е само за хомоядрени молекули Има изключения, като например [c.198]
Ентропията се увеличава, тъй като молекулите на продукта по-трудно (те хетероядрена) от молекулите на реагентите (хомоядрени). Все пак, това увеличение на ентропията е малък. [C.532]
По-долу като пример считаме молекули, принадлежащи към точка група симетрия на Те включват всички двувалентен хомоядрени и хетероядрена поливалентен линейна структура с център на инверсия HC СН, С = 0 и m = 0. D. [C.192]
Фигура 1. Относителното разположение на молекулни орбитали EN1 rgiyam хомоядрени двуатомни молекули и без взаимодействие - и - МО (а) и взаимодействие с (б) [С.11]
Книгата е цялостна и лесна за разбиране, и най-важното методически правилно въвежда теорията на химичната връзка и резултатите от нейното прилагане към описанието на структурата и свойствата на съединения от различни класове. Представена за първи път преди квантовата идеи J. Люис на валентност (Lewis ovyh) структури и показва, че вече въз основа на декларации относно социализацията на електронни двойки и и прост октет правило с помощта на логически разсъждения за многообразието на взаимоотношения и официални обвинения е възможно без сложни математически изчисления, както се казва на пръстите на ръцете. да обясни структурата и свойствата на много молекули. По същество, това започва с въведение в съвременната химия пронизва всички мнения и условията на една от двете основни подходи към квантовата теория на химична структура, начин на валентните връзки (Британска Колумбия). За съжаление, въпреки простотата и интуитивен привлекателността на тези идеи, метода на слънцето е много сложно за изчисления и не позволява качествено да се реши въпросът за енергията на електронните състояния на молекулите. без които е невъзможно да се съди за тяхната структура. Ето защо, по-долу квантовата теория на химичната връзка е представена главно в рамките на различен подход, метод на молекулно орбитален (МО). В примера на двуатомни молекули влезе ключ теория представителство МО на орбитални припокрият и енергийни нива МО, техният задължителен характер и възлови свойства. както и симетрията МО. Всички тази конструкция завършва общи схеми за МО и хомоядрени двуатомни молекули Гьоте -royadernyh дискусия и с тяхна помощ структурата и свойствата на много специфични системи едновременно става ясно, че някои от свойствата на молекули (например, магнитни) могат да бъдат обяснени единствено въз основа на квантовата теория МО. Следваща MO теория се прилага многоатомни молекули. а в някои случаи това се прави от гледна точка на локализирано MO (подобно на идеята за посоката на метода на слънцето връзки) и конструкцията им се въвежда хибридизация на атомни орбитали. докато в други, трябва да се прибегне до делокализираният МО. Дискусия на тези проблеми завърши интересна писмено точка на възможностите на молекулярната спектроскопия при определяне на структурата на съединенията тук са обяснени принципи на вибрационна спектроскопия [С.6]
За хомоядрени двуатомен вещество въртене сума над състояния Q = 50. Изчисли за нивото на земята 1) съотношението на броя на молекулите на ниво KTH за броя на молекулите на ниво нула, 2) фракция (от общо) молекули, които са на ниво 1 3) малка част от молекули, които са на ниво нула. [C.123]
В схема () показва последователните етапи усложнение химически организация на материята (разбира се, горната схема е както фрагмент с обща организация на материята strukt S, т. Е. Разширяване верига). От схема (2) показва, че молекулни сътрудници са оформени на хомоядрени или хетеро-ядрен молекули, докато атомните сътрудници образувани от атомни частици. заобикаля втория молекулярно ниво. Образуването на агрегати може да възникне атомен има две независими механизми, или директно от ядрените частички (преминаващи двата слоя) или се дължи на взаимодействието на атомните сътрудници. Най-типичните примери са атомните ядрени агрегати и метални решетки [С.9]
Ние сега започва да се пренесат с електрони последователно молекулни орбитали -by два електрона орбитални на и по този начин се изясни електронната структура на хомоядрени двуатомни молекули LI2 N62- Всички тези молекули има предимно четири електрони, които са били изолирани атоми на вътрешния 15-орбитали 51h на. В двуатомен молекула, две от четирите вътрешни електрони са в свързващ молекулно орбитален А1 и две орбитите и antibonding на. Въпреки това, тези четири електроните нямат ефект върху връзката. и за да можем да приемем, че те все още са по 1x атомни орбитали. химичната връзка на молекулите в разглежданите тук се определя само от външните електрони с атомно ниво с квантово число п = 2, така че е необходимо да се разглеждат само тези молекулни орбитали. които се образуват от атомни 2s и 2P орбити. [C.525]
Квадратите на тези функции се определя от разпределението на електронната плътност. съответстваща на всяка молекулна орбитален. Всички schest молекулни орбитали са показани схематично на фиг. 13-25. Три от тях са задължителни, и три-дезинтегриращи. Техните енергийни нива са показани на Фиг. 13-26. Имайте предвид, че по примера смятах орбитали илюстрира общото правило. при което орбитален с bolschoy брой възлови повърхности имат по-висока енергия. Валидността на това твърдение могат да бъдат проверени на орбитите на хомоядрени и хетеронуклеарна двуатомни молекули. obsuzhdavschihsya в Chap. 12, и дори на функциите на вълната на водороден атом. [C.575]
В GT 12 обсъдихме електронната структура НС1 § отбележи, че хетероядрена двуатомни молекули са полярни, а хомоядрени dvu.chatomnye неполярни молекули. Неполярният молекула има нула (или близо до нула) диполен момент. има много taki.h в които индивидуално комуникация между полярни многоатомни молекули. въпреки неполярен молекула като цяло. Като пример за SCC. At, структура на молекулата. Това е показано на фиг. 13-28, както и. Тъй хлоро-повече електроотрицателна елемент. от въглерод, свързващи двойки електрони се движат към хлорни атоми. В резултат на това всяка С-С връзка става малък дипол yument%. По двойки вектор присъединителни дипол връзки генерира две равни по големина и противоположни по посока дипол CC1 фрагменти. както е показано на фигури, 13-28, б. Symmetrical форма четиристенните молекули SSC определя неговата нула диполен момент така, I4-неполярен молекула. [C.579]
Валенцията и молекулярна структура (1979) - [c.66. c.72]
Свързани статии
