В процеса на живота в каквито и да било жив организъм Sauveur-shayutsya сложни и разнообразни химически трансформации от различен характер. По-голямата част, и в които не са данни, дори и всички химични реакции в живите организми-макс се случват с биологични катализатори - Fer ченгета. Това обяснява и лекотата на преминаването на тези реакции.
Ензим катализа се различава значително от катализа химическата небе. Тези различия са, както следва.
Каталитичната активност. Според биологичната активност на ката-рекуператори милиони пъти по-голяма от активността на химически катализатор беше ка. Дори и най-доброто от неорганични катализатори - платина атомно - по-ниско, например, на ензима каталаза тивността на AK-1 на активното място на хиляди пъти. Оценка на ензимната реакция може да бъде измерена чрез следния пример: 1 мол ензим може да се раздели захароза в едно с 1,000 мол от захарно цвекло.
Следи от ензими, способни да разцепват огромно количество реагенти. Така 1гр на кристални пепсин разцепва 50 кг коагулиран яйце бели и 1 г кристален ренин ролки 72 тона мляко. Пероксидаза ензим, което ускорява окислението на субстрата поради водороден пероксид, упражнява неговата активност при разреждане от 1 тегл. ч. ензима в 500 милиона тегл. ч. вода.
Според препоръките на Международната комисия за кръгли каталитична активност Ензими nomenkla на ензима може да се характеризира с "молекулна активност", с която следва да се разбира броят на молекули на субстрата или еквивалентността-Ing засегнатите групи на един минута превръща една молекула ензим при оптимална концентрация на субстрат.
Висока химическа специфичност. За разлика от химически катализатори, ензими имат много по-голям спе-fichnostyu: Всеки от тях действа само при строго дефинирани позиция реакция или група от реакции, протичащи в тялото. Предполага се, че в човешкото тяло, като в същото време функционални niruet около 1000 различни ензими. По този начин те образуват сложни ензимни системи, които осигуряват жива клетка да тече редица строго последователно и Comp сова между реакции. Ако ензими не са имали такава висока специфичност, това ще доведе до бързо разлагане направи всички вещества в клетките, както и за смъртта на целия организъм.
Специфичността на ензими се разделя на абсолютна (или химикали) и стереохимична.
Абсолютната специфичност - е действието на всеки ензим в вещество добре дефиниран химичен състав. Например, уреаза ензим катализира само хидролизата на карбамид, на ензима пепсин - само откачване протеини каталаза действа само на водороден прекис.
Стереохимичната специфичността е, че FER-менти действат само на някои стереоизомери на органични съединения-Ing. Като пример за такава специфичност, но можем да посочим действието на два ензима: # 945; - и # 946-глюкозидаза. Фер-ченге # 945-глюкозидаза актове само по # 945; -glyukozidy и # 946-глюкозидаза - на # 946; -glyukozidy, както се вижда на диаграмата:
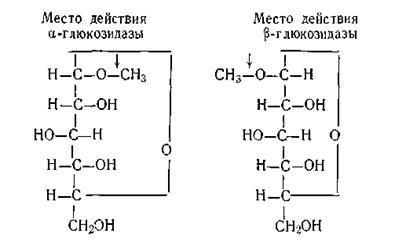
Причините за такава висока специфичност на ензимите, все още не е напълно изяснен. Има няколко теории за обяснение на механизма на действие на ензими.
По този начин, немски химик Фишер да обясни специфичността на ензима по отношение на този субстрат по време на предварително gested хипотезата за "ключ". Съгласно тази хипотеза субстрат молекула точно съответства по своята форма на определен сайт на молекулата на ензим. Fisher смята, че "ключ" - точка субстрат, но подходящи за ензима - "замъка" без каквато Naru-sheniya форми на двете молекули. Въпреки това, проучванията показват, че в някои случаи, хипотеза Фишър не може да обясни някои от фактите.
За да се постигне тази теория в съответствие с експерименталните данни, Koshland малко модифициран модел на "ключ - ключалката". Според хипотезата си субстрат, присъединявайки се към активния център променя формата си, като по този начин се гарантира, усъвършенстват сажди лзвани. С други думи, функционалните групи в активния център да специфична пространствена конфигурация само ако силите на наличието на под-слой.
По този начин, образуването на ензим-субстрат комплекс може да се осъществи про-електрически зареден поради двете групи на ензима и субстрата. Такива групи могат да бъдат
В резултат на това взаимодействие в субстрата може proish-ди някои химически модификации оловно-B Включване mations нови функционални групи с доста различен-полярни свойства. След реакцията на ензима и субстрата подобни Ott кимва един от друг, и ензимът е отново готова да се присъедини интер-действието с друга молекула на субстрата. Химически модифицирани разцепва реакционен продукт субстрат.
По този начин, специфичността на ензима се определя от неговата конфигурация, структурата и електрически свойства на активните групи на ензима.
Деактивацията. Vprotsesse каталитична реакция ензим постепенно се свива и губи своята дейност. Това явление се нарича обезвреждането. Опитът показва, че има по-голяма активност от ензим, така че е повече време разпада по време на катализа. Това свойство на ензими съществуващите член-venno различават от неорганични катализатори, които, както вече бе отбелязано, остават непроменени в реакционните продукти.
Структурата на ензимите. В сравнение с неорганични катализа-серпентини ензими имат много по-сложна структура. Всеки ензим съдържа протеин, и която се дължи на високата специфичност на биологични катализатори. Според неговата структура ензими се разделя на две големи класа: еднокомпонентни и двукомпонентни. За да включите еднокомпонентна Fermi вас, състоящ се само от белтъчни тела, които имат съвкупен готворителни свойства. Тези ензими активна роля групи,-запълва определени химически групи, които съставляват протеиновата молекула, и получи името на активни центрове.
Понастоящем повече от 100 известен един компонент FER на полицаи
lucheno в кристална форма.
За двукомпонентна включват ензими, които са съставени от NY-протеин и не-протеин част, наречена протезна група. активен протезна група е помолен да нарича вана Агон и носител протеин - Feron или друго апоензим. Проучванията показват, че протеиновата част на двукомпонентен ензим (Fearon) има решаващо влияние върху спецификата на неговото действие. Въпреки това, активното съединение от групата на протеин води до огромно увеличаване си каталитична активност.
Доказано е също така, че силата на свързване на Агон и час Feron-ТА на различни ензими. Някои ензими, като дехидрогенази, катализиращи окисляването на различни субстрати, NY отнемане на водород (дехидрогениране) тази връзка е чуплив-ТА. Такива ензими лесно се разпадат и се дезинтегрират за Агон и Feron. По предложение на известния френски биохимик G. Bertrand, болка, лесно се отделя от протеин част на фермата-ТА, обикновено се нарича коензими.
Като пример могат да се споменат двукомпонентна ензим пируват декарбоксилаза ензим, който разцепва пирогроздена киселина до ацеталдехид и въглероден оксид (IV):
Химичната природа на активната група на пируват декарбоксилаза вече е напълно разбран. Това е съединение молекулата на витамин В1 и два остатъка на фосфорна коте партиди. Това е пример на пируват декарбоксилаза ензим ав-тивна група, на която съдържа витамин. Както е показано Изследване на бани-витамини са неразделна част от редица важни ензими (каталаза, пероксидаза, и т.н.).
Влияние на външни условия. По своята същност, ензими-telno значително по-чувствителни към промени във външните условия от неорганични катализатори. По-специално, "работа" ензими в много тесен температурен диапазон. температура оптимума на най растителна ензимите 313-333 К, корема-ционни ензими 313-323 С. Ако температурата надвиши предварително Ly, ензимна активност бързо намалява и при 343-353 К е тяхното необратимо унищожаване, причинени от денатуриране на протеин-нето. Само много малко ензими са в състояние да дефинира условията-ционни издържат на топлина до 373 К без загуба на актив-ност.
Неорганични катализатори, тъй като опитът показва, са по-лице, което работи при по-високи температури - до FIR MULTI-сто градуса.
За разлика от неорганични катализатори, ензими проявява чрез тяхната активност в много специфичен обхват от стойности на рН. Таблица. 2.1 показва стойността на рН, при която времето лични ензими упражняват тяхната максимална активност.
Както се вижда от тази таблица, обхвата на рН стойности много ши скала за активността на различни ензими. Ефект на рН на ензимната активност се дължи на промяна на йонизация държави не само на ензима и субстрата самостоятелно, но също така и ензима - субстрат комплекса.
Различни ензими имат различни оптимално рН.
Ензими с различни култури / имат различни оптимални стойности на рН:
Оризът е 4.5 В пшеница, 6,0 В общи линии: Vkat. = F (T, рН) Кинетиката на биохимични реакции, описани от Michaelis - Menten уравнение. Michaelis и Menten проучен скоростта на реакцията на АТР хидролиза от миозин. Протеини актин, миозин и ATP играят решаваща роля в процеса на мускулното съкращение. АТР хидролиза → ADP + F + E Е - енергията се използва за свиването на мускулите. ATP - субстрат (реагент); където # 965; 0 - начална скорост на реакцията; # 965; 0max - теоретично определени първоначалната скорост на реакцията при субстратни концентрации макс; S0 - начална концентрация на субстрат; KS - като субстратна концентрация, при която: # 965; 0 = Уг # 965; 0max 1) при ниска зависимост S0 # 965; 0 = F (S0) е линейна (реакция се подчинява на уравнението # 921; - ред); 2) когато S0 »KS реакция е нулев порядък в концентрация на субстрата, т. Е. началната скорост е независимо от концентрацията на субстрата, насищане случи.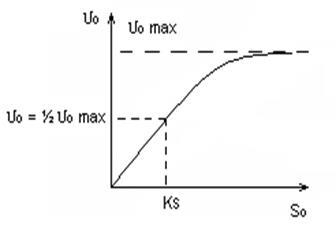
Свързани статии
