Електрохимични устройства и процеси
Тъй като редукционната реакция придружена с пренос на заряд, те могат да носят електрически ток, както и обратното - да получава електрически ток, поради изтичането му. В съответните процеси и устройства използват електроди и електродни потенциали.
Концепцията на потенциала на електрода.
Ако долната метална плоча във вода или разтвор, съдържащ йони на метал, след процесите на метал разтвор поради метал разтваряне отлагане възниква разлика или потенциал скок, който зависи от естеството на метала, концентрацията на разтвора и температурата. Този скок се нарича потенциала електрод на метала. Споменатите равновесие се изразява чрез уравнение, което отчита хидратация йон:
в разтвор на метала
Потенциалът съответстващ на този баланс, наречен потенциал равновесие електрод.
Стойността на к е невъзможно да се определи абсолютната стойност. Следователно, възможностите на всички електродите се определя по отношение на стандартен водороден половината клетка (електрод). (Виж фигура 7.1), който потенциал се определя да бъде нула: й около 298 (2Н + ® Н2) = 0. стандартен водороден електрод се състои от съд с 1N. кисел разтвор, който е пропуснат платинен електрод в контакт с водород газ. P = налягане 101,3 кРа.
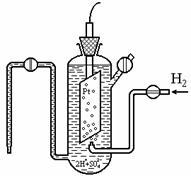
Фиг. 7.1. Стандартна водороден електрод
Балансът на електрод е установено 2Н + р + 2? Н2 (д). Нулева стойност на к за този електрод се определя от факта, че DG 0 е (Н +) = DG 0 е (Н2) = 0. Platinum се използва поради инерция, но и защото е катализатор на електронен трансфер (процесът на установяване на равновесие ускорява но състояние на равновесие се, т.е. функция DH, DU, ГД, DS, остава непроменена при постоянна температура).
Потенциал определени по отношение на стандартен електрод при стандартни условия (т.е. около 298 J) са дадени. За метали от химични данни (NN Beketovym), последвано от измерване на J 298 определен брой метал активност, която в момента е nazavanie електрохимични напрежение серия метали (tabl.12.1).
Стандартни електродни потенциали на някои метали й 0
Потенциалът за електрод, измерен при стандартни условия
(Т = 298К, [мен: п +] = 1 мол / л) в сравнение със стандартната водороден електрод, наречена стандарт потенциал електрод на метала и се означава с J 0. стандарт потенциал електрод е количествена характеристика на химичната активност на метал, т.е. способността му да се откажат от своите валентен електрон и отиде в разтвор, както йони.
Основните характеристики на редица напрежение.
По-малката стойност J, толкова по-силно изразена активност намаляване метал.
Ако условията различават от стандарта, за да се изчисли електрод потенциал Нернст формула се използва:
където J 0 - стандартен електрод потенциал на метала,
п - брой електрони, които участват в този процес,
F - Фарадей константа (96500 C / мол),
R - универсална газова константа (8.31 J · мол - 1 · К - 1)
Т - абсолютна температура (K).
Ако горното уравнение за замяна на постоянните числените стойности, то ще имат следния вид:
От формула Нернст показва, че стандартната концентрация на катиони равна 1М φ = й 0. т.е. равновесие потенциал на металния електрод е равна на стандартната си потенциал.
Свързани статии
