DIFFUZIONNO контролирани реакции. р-ТА скорост до ryh конвергенция определя от дифузията на взаимодействие видове, след което взаимодействието им. То се провежда почти мигновено. За реакциите дифузия контролирани, включват: бимолекулярен рекомбинация на атоми и йони в р-Rah, рекомбинация и диспропорциониране радикали и радикални йони. р-ТА с молекулно БЕЗПЛАТНО. атоми или радикали в кинетиката на дифузия контролирани реакции на твърдото вещество и др., е описан от теорията основава на предположението на приложимост на postupat. самостоятелно макроскопска молекули. закони на дифузия на Фик; на влиянието на дифузия трансфер маса кинетика на химикал. р-ционните см. Чл. Macrokinetics. Теория дифузия контролирани реакции се използва, за да обясни повече. процеси, свързани с разпространението на микрочастици: растеж на колоидни частици галваничното на. луминесценция закаляване. дифузия горене (играе роля на разпръскване на частици окислител посадъчен в средата -. капка гориво), и други кинетична .. особено дифузия контролирани реакции, графично илюстрирани чрез пример процесите на бимолекулярен типа:
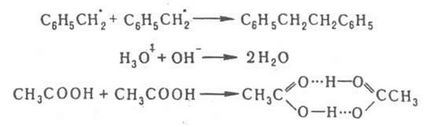
Обикновено това р-ТА екзотермична и имат малък активиране на енергия ([10 кДж / мол). Ако те се срещат в газова фаза, скоростта им е решена вероятност за сблъсък на частици или gazokinetich. раздел (вж. напр. йони във Газове). Кондензирани. фаза, например. в р-ре-реактивен частици А и В, сблъсък с молекули на р-erator произволно премества досега до среща на един структурен клетъчна течност. Тази среща може да се счита като образуват двойка дифузия [A. V], в резултат на взаимно postupat. самостоятелно частици. P-ще се получи в два последователно. Стъпка продукти където кД и k'D - константи на формиране и гниене скоростта на дифузия двойки респ. кг и характеризира степента на превръщане на продукти дифузия двойка р-ТА. Константата на експериментално наблюдавана скорост на р-ТА Koba = ST кД (k'D KC +) - 1, когато състоянието k'D >> постъпления KC бимолекулярен р-му в кинетична. режим и Koba = ST = KAV. = CAV където кД / k'D; в ST> Ш процес се ограничава чрез дифузия и Koba = кД. За първи път на проблема с описващ дифузия контролирани реакции се анализира чрез М. Smoluchowski прилага колоиди коагулация. квази-стационарен режим скорост заседателни частици А и В: V = 4. 10-3 р DrNA [A] [B] мол / (л а.), където D е сумата на коефициентите. дифузионни частици А и В (cm 2 / и), R - сумата на техните радиуси (cm), NA - Число на Авогадро. Частиците в този случай се считат като сфери и течност. в рояк, те дифундират - като изотропна среда. Квази-стационарен режим р-ТА набор за време тон
R 2 / D (в ниско вискозни течности т
10-8 - 10-10). Ако частиците са привлекателни или отблъскващи сили (йони или молекули. Имащ диполен момент), тогава R се използва вместо т. Наречен. ефективното радиуса на срещата (Reff):
където U - потенциала на молекулни взаимодействия. к - е Болцман постоянна. Т - абе. темп. Коефициенти. дифузия свързани с вискозитет р-erator часа. Според законодателството на Стоукс - Айнщайн, за сферична. радиус на частиците R в изотропна среда на 10 юни D = KT / 6 стр R з и две идентични Kd = 2.7 частици. 10 март NA KT / ч (л / мол. Sec). Експерименталните данни потвърждават прогнозира обикновено съотношението Kd зависими от Т / ч. Въпреки корема. стойността на експерименталните и изчислените стойности на Ш не винаги съвпадат. За по-добро съвпадение прилага т. Наречен. mikrotreniya фактор F, до позиция зависи от размерите на частиците и молекули разсейващи р-erator, и използване на р-LU Stokes - Einstein като: D = 10 - 6 KT / 6 стр R з е. Горната теория позволява да се изчисли скоростта на радикален рекомбинация постоянно напрежение. на някои алкил, алкокси и fenoksilnyh въглеводородни радикали в р-celeration, в добро съгласие с експеримент. В случай на взаимодействието. големи частици с определена реакция център (атом или атомна група) на скоростта на дифузия контролирани реакции значително влияе взаимното ориентиране на частиците в структурната клетката. Благоприятно за р-ТА ориентация на частиците, както и тяхното среща, поради относително въртене със случайни сблъсъци разстройства и следователно се разглеждат като вихър резултат. и postupat. дифузия. За р-ционни поливалентни частици обикновено се изисква, тяхното определено взаимно ориентация. В този случай, притежават химически реагенти. анизотропия. към небето се характеризира sterich. фактор P [1. дифузионно контролирано взаимодействие на реагентите химически третирани като анизотропна дифузия контролирано среща две частици - сфери с "черни петна", когато ято е в контакт черни петна. Константата на скоростта на р-ТА = 4 кД р10 - 3 ДНК Reff л / (мол гр.), където Reff е свързан с сумата от радиуса R и sterich частици. съотношение фактор F: .. кД, че не е пряко пропорционална на P, като р-ции в газова фаза и поради повтарящи връзка, частици в клетката. притежавани до обръщане придружени частици, което води до хомогенизиране R. D iffuzionno контролирани реакции изследвани методи, разработени за бързи р-ции, по-специално импулс фотолиза. пулс радиолиза. от прекъснато запалване. EPR и сътр. Скоростните константи атоми и радикали рекомбинация в р-ма има стойности от порядъка на 10 9- до 10-8 л / (мол. S).
===
App. Литература: Entelis ДВ Teager RP кинетика на реакции в течна фаза, М. 1973; Melvin Hughes ЕА равновесие и кинетиката на реакциите в разтвори. на. от английски език. М. 1975; Ovchinnikov АА Timashov SF Бял АА кинетика на дифузия контролирани химични процеси, М. 1986 ЕТ Denisov.

Свързани статии
