това валентност електрони от външния слой на алкални метални атоми от лесно чрез превръщането им в положителни йони са поотделно изисква. Това се дължи на това. Съединенията на алкалните метали с други елементи, конструирани в съответствие с вида на йонна връзка.
Редокси реакции на алкалните метали се държат като силни редуциращи агенти и това повишава способността на метал към метал зареждане с увеличаване на атомното ядро.
Сред алкалните метали показват най-високата реактивност. Сред алкалните метали всички напрежения са разположени в началото на серията. Електронни външен електронен слой е само валентност електрони, така алкални метали във всички медни съединения. Степента на окисление на алкални метали обикновено +1.
Физични свойства на алкалните метали са показани в таблица. 19.
Физични свойства на алкалните метали. Таблица 19
Точка на топене, ° С
Точка на кипене, ° С
Твърдост на
Типични представители на алкалните метали са натрий и калий.
26. ■ Осъществяване на обща характеристика на алкалния метал по следния график:
а) сходствата и различията в структурата на металните атоми алкални;
б) поведението на алкални метали в редокс реакции;
в) вида на кристална решетка в съединенията на алкални метали;
г) конкретните промени във физическите свойства на металите в зависимост от радиуса на атома. (Вж. Response)
§ 97. Натриев
Електронни конфигурация LS натриев атом 2 2s 2 2p 6 3s 1. структурата на външния слой:
Натриев се намира в природата само под формата на соли. Най-често натриевата сол е натриев хлорид натриев хлорид и калиев хлорид sylvinite минерална · NaCl и някои сулфати, като глауберова сол Na2SO4 · 10H2O, срещащи се в големи количества в залив море Гарабогажкол Каспийско.
От таблица сол NaCl натриев метал, произведен от електролизата на стопената сол. Инсталация за електролиза е показано на фиг. 76. В стопената сол се понижава електроди. пространство анод и катод е разделена от диафрагма който изолира полученият хлор от натриев на обратна реакция не е настъпило. Положителен натриев йон приема електрон от катода и се трансформира в неутрален натриев атом. Неутрални натриеви атоми са събрани на катода в стопен метал. Настъпили в процеса на катод могат да бъдат представени чрез следната схема:
Na + + Na 0.
Тъй катода настъпва приемане на електрони, и всяко електрон приемане атом или йон е намаляване, натриевите йони се редуцират върху катода. В анода, хлорни йони даряват електрони, т. Е. процеса на окисляване и отделяне на свободна
газообразен хлор, която може да бъде представена със следната схема:
Cl - - д - → Cl 0
Полученият натриев метал има сребро-бял цвят, тя може лесно да се реже с нож. Разрезът в натрий, ако прегледа веднага след прерязването има светло метален блясък но бързо петни поради изключително бързо окисляване на метала.
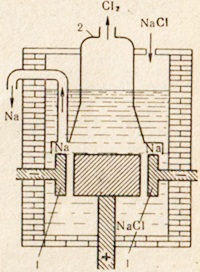
Фиг. 76. Устройство за електролиза на стопена сол.
1 - пръстеновиден катод; 2 - звънец за отстраняване на хлор газ от анодното отделение
Ако натриев окисляват в малко количество кислород при температура от около 180 °, се получава натриев оксид:
4Na + O2 = 2Na2O.
По време на това се получава изгаряне на кислород, натриев пероксид:
2Na + O2 = Na2O2.
Така натриев заслепяването жълт пламък изгаряния.
Поради бързо и лесно окисляемост натрий се съхранява под слой от парафин или восък, където восъкът е за предпочитане, защото керосин е все още някои разтваря количество въздух и натриев окисляване макар и бавно, но все още се среща.
Натриев да се получи съединение с водород - хидрид NaH, в която водороден проявява окисляване - 1. Това сол като съединение, което от естеството на стойността на химична връзка и окисление се различава от летливи хидриди на елементи на основната група IV-VII групи.
Метален натрий може да реагира не само с кислород и водород, но също с много прости и сложни съединения. Например, когато смачкани с хаван и натриев сяра реагира бурно с него, образувайки натриев сулфид:
2Na + S = Na2S
Реакцията е придружен от мига, така че мазилката трябва да се държат далеч от очите и увийте с кърпа в ръка. За реакцията трябва да се малки парченца натрий.
Натриев енергично изгаря в хлор за да се образува натриев хлорид, който е особено добре се вижда на хлор-калциев тръба, през която силно се нагрява и разтопен натриев хлорид се пропуска ток:
2Na + Cl2 = 2NaCl
Натриев реагира не само прост, но също така със сложни материали, например с вода, измествайки водород тях. защото е много активен метал в електрохимичната серия е много лявата от водород и лесно замества последният от водата:
2Na + 2H2O = 2NaOH + Н2
Запалена алкален метал не може да се погасява с вода. Най-добре е да го напълни с прах калцинирана сода. В присъствието на натриев безцветно факел пламък е оцветен в жълто.
Метален натрий може да се използва като катализатор в органичния синтез, например в производството на синтетичен каучук бутадиен. Той служи като изходен материал за получаването на други натриеви съединения, като например натриев пероксид.
■ 27. докаже с помощта на уравненията, дадени в текста на реакции с метален натрий, той се държи като редуциращ агент. (Вж. Response)
28. Защо е натриев не може да се съхранява във въздуха?
29. зеницата потопени в меден сулфат разтвор на натриев парче, с надеждата да се отдели от метални медни соли. Вместо метал червен посинял желатинова утайка. Описва се наблюдава реакцията и пишат уравнения в молекулното и йонна форма. Как трябва да се промени на условията на реакцията, реакцията да се получат желаните резултати? Добави уравнението в молекулните, пълни и намалени йонни форми.
30. Съдът с 45 мл вода се поставя 2,3 г метален натрий. Това е концентрацията на натриев хидроксид, образуван от завършване на реакцията.
31. Какви средства могат да се използват за гасене на пожар, с участието на натрий? Дайте мотивиран отговор. (Вж. Response)
§ 98. кислород натриев съединение. сода каустик
Кислородни съединения на натрий, както вече бе споменато, са натриев оксид Na2O и Na2O2 натриев пероксид.
Натриев оксид Na2O специално значение. Той реагира енергично с вода до образуване на натриев хидроксид:
Na2O + H2O = 2NaOH
Натриев пероксид Na202 - жълтеникав прах. Това може да се разглежда като вид на сол на водороден пероксид, защото неговата структура е същата като тази на Н2О2. Като водороден пероксид. натриев пероксид е силен окислител. Под действието на вода, образува алкален и водороден прекис:
Na2O2 + H2O = H2O2 + 2NaOH
Водороден пероксид, образувана по време на действието на разредена киселина, натриев пероксид:
Na2O2 + H2SO4 = H2O2 + Na2SO4
Всички по-горе свойства на натриев пероксид позволява да се използва за избелване на всички възможни материали.
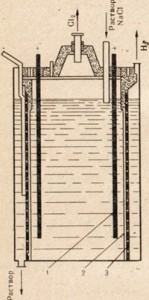
Фиг. 77. Устройство за електролиза на разтвор на натриев хлорид.
1 - анод; 2 - диафрагма отделяне на анода и катодното отделение; 3 -katod
Много важно натриев съединение е натриев хидроксид или натриев хидроксид, натриев хидроксид. Тя се нарича още сода каустик, или просто каустик.
За натриев хидроксид се използва натриев хлорид - най-евтиният естествен натриев съединение чрез подлагане на електролиза, но в този случай не се използва стопилката и разтвор на сол (Фигура 77). Описание електролиза физиологичен см. § 33. На фиг. 77 показва, че анодна и катодна пространство е разделена от диафрагма. Това се прави с цел, че получените продукти не влизат в контакт един с друг, например Cl2 + 2NaOH = NaClO + NaCl + H2O.
Сода каустик - бяло кристално твърдо вещество, напълно разтворим във вода. При разтваряне на натриев хидроксид във вода, голямо количество топлина и разтворът се нагрява силно. Сода каустик трябва да се съхранява в добре затворени контейнери, за защита срещу проникването на водна пара под действието на които може силно хидратирана, както и въглероден двуокис, чрез действието на сода каустик, която може постепенно да се превърне в натриев карбонат:
2NaOH + CO2 = Na2CO3 + H2O.
Сода каустик е типичен алкална, така предпазни мерки при работа с него са същите, както бихте направили с всеки друг алкали.
Сода каустик се използва в много индустрии, например почистване масло производство сапун на мазнини в хартиената промишленост, в производството на синтетични влакна и оцветители Фармацевтични и сътр. (Фиг. 78).
• Напишете в бележника областта на прилагане на натриев хидроксид.
От натриевите соли трябва да се отбележи, готварска сол NaCl, който служи като основна суровина за производство на натриев хидроксид и натриев метал (за подробности на тази сол см. P. 164) сода Na2CO3 (cm. P. 278), натриев сулфат Na2SO4 (cm . стр. 224), натриев нитрат NaNO3 (вж. стр. 250) и други.
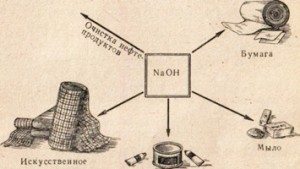
Фиг. 78. Използването на натриев хидроксид
■ 32. Описва метод за получаване на сода каустик чрез електролиза на натриев хлорид. (Вж. Response)
33. Сода каустик е достъпно за действието на натриев карбонат, гасена вар. Направи молекулно и йонна форма на уравнението за тази реакция, и се изчисли колко сода, съдържащ 95% карбонат изисква да се получи 40 кг натриев хидроксид.
34. Защо разтвор за съхранение на натриев хидроксид в колби с наземни запушалки корк "възползват" и не може да бъде отстранен? Ако, обаче, държи бутилката отмени във водата за определен период, тръбата се изважда свободно. Обяснете позовавайки се на реакциите, които в процесите се проведе в този случай.
35. Добави реакциите в молекулните и йонни форми, характеризиращи свойства на натриев хидроксид като типичен алкален.
36. Какви предпазни мерки трябва да се вземат, когато се работи с сода каустик? Какво първа помощ мерки следва да се предоставя в случай на изгаряния с сода каустик? (Вж. Response)
§ 99. Калиев
Калиев К - също е доста обща алкален метал, при което количеството на натрий в атомната радиус (четвърти период) и следователно с по-висока химическа активност от натрий. Електронни калиев атом конфигурация 1s 2s 2 2 2 2p 6 3s 3P 6 4s 1.
Структурирайте неговия външен електронен слой
Калиев - лек метал, който е добре реже с нож. За да се избегне окисление, както и натрий, съхранява под керосин слой.
Калиев реагира с вода дори по-бързо от натрий за образуване на алкален и водород развитието който светва:
2K + 2KOH + 2H2O = Н2.
Изгарянето на кислород (инсинератора е препоръчително да се вземе по-малки парчета метал натриев отколкото за горене), той, като натрий, изгаряния много енергично, за да образуват калиев пероксид.
Трябва да се отбележи, че в циркулацията много по-опасно калиев натрий. Силна експлозия може да се случи, дори когато калий се реже, за да лекува той също трябва да бъдат внимателни.
калиев хидроксид или калиев хидроксид КОН - бяло кристално твърдо вещество. Калиева основа във всички отношения, подобни на натриев хидроксид. Те са широко използвани в индустрията, но сапун производствените си разходи по-скъпи, така че това приложение като NaOH, не е така.
калиеви соли трябва да бъдат споменати специално, тъй като някои от тях са широко използвани като торове. Такова калиев хлорид, калиев хлорид, калиев нитрат KNO3, което също е азотни торове.
■ 37. Как си обяснявате факта, че калиев хидроксид химическата активност на натриев хидроксид? (Вж. Response)
38. кристализатора вода спадна калиев парче. След като реакцията приключи, се сложи малко цинков хидроксид като бяло желеобразна утайка. Утайката беше изчезнал, а когато се изпитва с разтвор на фенолфталеин последно е бил боядисан в пурпурно. Какво химически процеси се проведе тук?
Какво вещества са в разтвор? Дайте мотивиран отговор.
39. Защо е калий, подобно на всички алкални метали, принадлежат към семейството и-елементи? (Вж. Response)
знам как
