Работа №8 (виртуална)
определяне на специфично съотношение на топлина при постоянно налягане на специфичната топлина при постоянен обем за въздух от адиабатно разширяване на
Целта на работата - да изучават закона за идеалния газ и основните разпоредби на класическата теория на топлинна мощност; определяне на съотношение на Поасон - съотношение на специфична топлина при постоянно налягане на специфична топлина сР при постоянен обем, CV чрез адиабатно разширение (от Clement - Desormes).
Количеството топлина, което трябва да се докладва за един мол от веществото за повишаване на температурата от 1 K, наречен моларен топлинен капацитет.
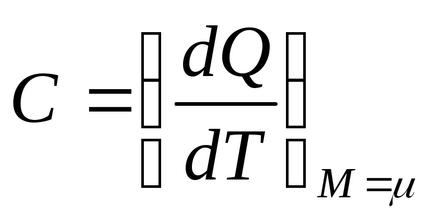
където Q - количество топлина подава към системата, Т - абсолютна температура, М - маса на газа, - маса на един мол от газ.
Както теорията и опита, капацитетът на топлина зависи от условията, при които газът се загрява, т.е. естеството на термодинамичен процес.
Загрява капацитет на газ при постоянно налягане (ср) е по-голям от капацитета на топлина при постоянен обем (CV). Лесно е да се покаже на качеството въз основа на първия закон на термодинамиката: номер teplaQ. предоставена на системата е да се увеличи вътрешната енергия и sistemyU rabotyA системата за точкуване на външни органи.
Ако газът се загрява при постоянен обем, операцията не се извършва, и всички вход топлина е да се увеличи границата на вътрешната си енергия U, т.е. само да се увеличи температурата на газа. Ако газът се загрява при постоянно налягане, тя се разширява и създава работа, която изисква допълнителни топлинния поток. Така, за да се повиши температурата на газа при определена стойност в изобарен процес изисква по-голямо количество топлина, отколкото когато изохорен.
Както следва от теорията на
където R-универсална константа газ.
Съотношението = Cp / CV влиза в Поасон уравнение описва адиабатно процеса, т.е. процес движение без топлообмен с околната среда (Q = 0):
Има IV1 - налягането и обемът на газ в първата държава; налягане 2 ф и обема на газ през втората държава.
Пълна изолация газ от околната среда не могат да бъдат изпълнени. Въпреки това, ако състоянието на параметрите на газ се променя много бързо, процесът може да се разглежда като приблизително адиабатен. На практика, адиабатен процес се извършва в някои топлинни двигатели (например, дизелови двигатели); на разпространението на шума в газове (бързо периодична промяна на налягането в малките региони на място), също се извършва адиабатно.
определяне схема е показан на фигура 1. Устройството се състои от стъклен контейнер 1, контейнерът 2 с компресиран въздух и U-образна течност манометъра 3. Има също два кран - впускателният клапан 4 служи за вход на газ в съда 1 от резервоара 2 и изпускателен клапан 5 за свързване на кораба в атмосферата.
Заключение работа формула.
Помислете за начина на Климент - Desormes. Напълнете въздух в стъклен съд 1 (вж. Фигура) и затваряне на клапана 4. С бързото компресиране на повишенията на температурата на въздуха. Ето защо, след разликата на входния прекратяване на манометъра течни нива постепенно ще намалее, докато температурата във вътрешността на съда става равна на температурата на околната среда. Нека наречем климатик в съда, след като състоянието на изравняване на температурата 1. Параметри състояние 1: V1 - единица обем на въздушната маса; t1 - температура на въздуха; Р1 - налягането в съда.
За tkroem kran5 и веднага след като налягането в атмосферното ниво, затворете го. Тъй разширяване се извършва много бързо, тогава процесът е в близост до адиабатната и следователно температурата пада до t2. Обем на единица маса на въздуха става равна на V2. Останалите в съд въздух ще премине към състоянието 2 с V2 параметри. t2. p2 (р2 -atmosfernoe налягане). Тъй температура Т2 е по-малко от външния, въздухът в съда е постепенно се нагрява (след-Следствие топлообмен с околната среда) за температура на въздуха t1 на околната среда. Това се случва, защото isochorically отопление клапанът е затворен. Налягане на въздуха в съда се увеличава в сравнение с атмосферното, и манометъра възниква разлика в нивата Н2. т.е. въздух отива в държавната 3 с V2 параметри. T1. P3.
По този начин, ние имаме три състоянието на водата, със следните параметри:
6) изчислява за всяко измерване с формула (7); намери средната стойност

7) грешка при измерване в този случай (определена стойност многократна употреба) се изчислява като средна стойност от п серия квадратичен измерване:
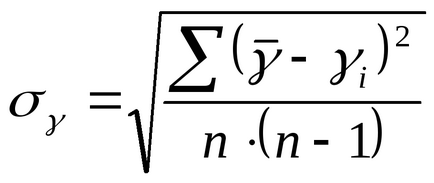
8) донесе крайния резултат.
1. Какво е специфичната топлина, молекулярно топлинен капацитет, специфична топлина? Как са свързани? Какъв е размера на топлинния капацитет? Какво определя моларната жегата?
2. Защо Cp> CV по отношение на първия закон на термодинамиката?
3. Какъв е процесът, наречен адиабатно? Какво уравнение описва адиабатен процес? Равен в адиабатни р-V координати.
4. Какви са термодинамични процеси, които протичат в тази работа? Равен тези процеси в р-Т координати, V-T, р-V.
5. Защо измерване на налягането трябва да се извърши веднага след плиска (изпразване) на въздуха, и след известно време?
Свързани статии
