Фиг.2. Разцепване г AOS в областта лиганд teraedricheskom на
Количеството енергия АД DG и г # 949; серия според закона за запазване на енергията е равна на първоначалната стойност на изродени орбитите на енергия E0. Разликата между енергиите на новите енергийни поднива, наречени (друг вариант) разцепване. Разделянето на енергията за комплексирането на лиганда се определя от природата.
За 3D-елементи експериментално създаден т.нар спектрохимичната поредица. в която отляво числена стойност # 916; монотонно се увеличава:
I -
<–N CS – (Подчертана атом директно прикрепен към комплексообразуващ агент) Лиганди лявата страна (слабо поле лиганди) произвеждат г ниска енергийна разцепване # 8209; подниво. В този случай, # 916; не надвишава енергията на взаимното отблъскване на двойки електрони, което води до запълване AO електроните в съответствие с член Gunda (вж. фиг. 3).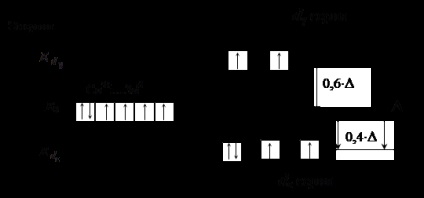
Фигура 3. Разпределението на електрони в г -podurovnya Co 3+ йон на
осмостенно поле подреждане слаб лиганд
Лиганди дясната част на (силни полеви лиганди) водят до значително количество енергия разделяне г -podurovnya, стойността # 916; надвишава енергията на електрон-електрон отблъскване сдвоени електрони. Това означава, че по-енергично благоприятни електроните запълват АД в нарушение на правило Hund му. Например, в случай на осмостенна подреждане на силните полски лиганди електроните ще запълни AO първо единия, после втората г # 949; серия и след това в същия ред г # 947; серия (вж. Фигура 4). За тетраедални поле, за да се отпише.
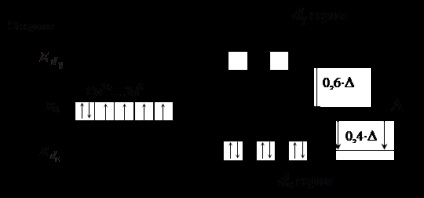
Фигура 4. Разпределението на електрони в г -podurovnya Co 3+ йон на
осмостенно подреждане на силни поле лиганди
Гражданска отговорност и ще има за цел да обясни на магнитните свойства на комплексите в присъствието на несвоен електрони - комплексът е парамагнитен, а в тяхно отсъствие - диамагнитно.
Ако г # 947; подниво в случай на осмостенно поле лиганд (или г # 949; подниво за четиристенен поле) е свободна (свободен) от, комплекс йон чрез абсорбиране на светлина квантовата преход е възможно от долната електронна енергия подниво да. Тези преходи определят присъствието на цвят в COP, като енергията на абсорбира Спектър на светлина е равно на енергията на разделяне. По отношение на един мол от абсорбиращ материал отговаря на отношението (J / мол)
,
където ч - Планк константа (Н = 6.63 х 10 -34 J х и); с - скоростта на светлината (с = 3 х 10 август м / сек); NA - Авогадро номер (NA = 6, 02 х 23 октомври мол -1); L - дължина на вълната на абсорбираната светлина, т.
Когато поглъщането на светлина с дължина на вълната от определена част на спектъра, веществото е оцветен в подходящ цвят. При смяна другият сложни лиганди с по-висока стойност напрегнатост на полето # 916; се увеличава, а комплексът започва да абсорбира светлинни лъчи с къса дължина на вълната. Тя променя цвета си. Например, комплекси на мед (II) в прехода от [CuCl4] 2+ на [Cu (Н 2О) 4] 4+ и [Cu (NH3) 4] 2+ цветът се променя от син през зелено до синьо-виолетов.
В характеризиращи стабилността на комплексите се използват такива термини като стабилност и инертност или лабилност и нестабилност. Стабилността на комплекса е неговите термодинамичните характеристики и е свързана с енергиите на това свързване и ентропията промяна на комплексообразуване. Инерцията и обратно, неговата лабилност са сложни кинетични характеристики в зависимост от темповете си лиганд заместване. Стабилни комплекси могат да бъдат инертни и лабилни. Например, йони [Cr (Н 2О) 6] 3+ и [Fe (Н 2О) 6] 3+ имат близки стойности на енергия връзка, т.е. Те имат почти същото съпротивление, но първия набор от лиганди е инертен и обмен бавно и втори лабилни лиганди са били обмен бързо. Нестабилни комплекси, най-често са неустойчиви.
Когато разтваря във вода COP като външната сфера дисоциира двете силни електролити за образуване на комплекс йон съставен от частици от вътрешната сфера и външната областта на йоните. Този процес се нарича първичен дисоциация. например
Заедно с този процес обикновено се ускори обратим дисоциация на вътрешната сфера, която се нарича вторична дисоциация. Така йон [Fe (CN) 6] 4-, този процес е в следните стъпки
първи етап [Fe (CN) 6] 4- ↔ CN - + [Fe (CN) 5] 3-
втори етап [Fe (CN) 5] 3- ↔ CN - + [Fe (CN) 4] 2- и т.н.
Количественият характеристика на силата на комплекс йон е дисоциационната константа на равновесие на вторичен процес, който се нарича нестабилността постоянна Knest на. Например, за йон [Fe (CN) 6] 4- нестабилност константи на първия и втория етап се изразяват чрез уравненията
;
На практика често използват обща нестабилност Knest постоянна стойност. което е характерно за общия баланс на вторичния дисоциация. Например, за йон [Fe (CN) 6] 4-
[Fe (CN) 6] 4- ↔ 6CN - + Fe2 +.
Knest е продукт на постоянна нестабилност на всички нива:
Понякога, вместо реципрочен на Knest използвате - устойчивост на търкане konstanoyi
Ако комплексите са от същия брой лиганди, тяхната стабилност може да бъде определена чрез постоянна общо за нестабилност: по-малко от Knest. по-стабилен комплекс йон.
Сравнение Knest комплекси реагент и продуктът (при постоянна QP) позволява да се установи реакция обмен равновесие смяна посока лиганд в разтвора. Например, за да обработи
сравняващи Knest йони [PtCl4] 2- и [PtI4] 2-. са равни на 1 х 10 -16 и 1 х 10 -31, съответно, показват, че комплекс йон - продуктът е много по-стабилен комплекс - реагент. Вследствие на това равновесие на този процес е силно измества надясно, а именно, тази реакция се извършва в посока напред.
Примери за решаване на проблеми
Пример 1. Определяне на заряд комплексиране на съединението [Co (NH3) 4 Cl2] NO2. Наречете го връзка.
Външната областта на COP съдържа един анион NO. Следователно, таксата целия вътрешен областта е 1, т.е. [Co (NH3) 4 Cl2] +. Вътрешната областта съдържа две лиганди NH3 група и Cl -. Степента на окисление комплексообразуващ означена с х и решаване на уравнението
+1 = 1 х 0 · х + 4 + 2 + (-1). Следователно х = 1.
По този начин, COP е комплекс катион. Съединение от заглавието: кобалтов нитрит dihlorotetraammin (1).
Пример 2. Защо йон [Cu (NH3) 2] + има линейна структура?
Определя такса комплексообразуващ в този комплекс йон
+1 = 1 х 0 · х + 2. Следователно х = 1.
Електронната структурата на йон валенцията на поднива Cu + 10 съответства на конфигурацията 3d 4s 4P 0 0. Тъй 3d - подслой не съдържа свободни места в образуването на връзки на механизъм донор-акцептор (като акцептор) от Cu + включат един 4s и 4P орбитали един който хибридизира по тип SP. Такъв тип хибридизация (вж. Таблица. 1) съответства на линейната структура на комплекса.
Пример 3. Определяне на вида на хибридизация AO централната йон и геометрична структура на комплекс [HgCl4] 2-.
Електронната конфигурация на централната йон Hg 2+. 5d 10 6s 0 0. 6p и електронен блок-схема може да бъде представена както следва
Пет 3d електроните е напълно разпределени в орбитали 3d # 949; серия, тъй като разделянето на енергия, която се проявява, когато общуват с лигандите силното поле е достатъчна, за да се увеличи максимално сдвояване на електрони. Безплатен 3d. 4S орбитали и 4R- подложени г 2 SP 3 -hybridization и предизвикват осмостенно сложна структура. Комплексът се намира на парамагнитен, като има един свободен електрон

Пример 5. производител образуване на връзка енергия диаграма в комплекса [CrF4] - и определяне на типа на хибридизация.
Електронен формула Cr 3+. 3 ... 3d 4s 4P 0 0 монодентатен лиганди 4d 0. F - форма четири # 963; -връзките са слаби-полеви лиганди и създава тетраедални поле
Безплатна две 3d. един 4s и 4P AO един комплексообразуващ хибридизира г-SP 2 тип. резултатът е парамагнитен комплекс тетраедални конфигурация.
Пример 6. обясни защо йон [CoF6] 3- парамагнитни, и йон [Co (CN) 6] 3- диамагнитната.
E-комплексиране формула Co 3+. ... 3d 6. осмостенна поле лиганд F - (слаб областта лиганд) се появява леко разделяне d-подслой, така че електроните запълват AO в съответствие с член Gunda (виж фиг.3.). В този случай има четири несдвоен електрон, така че йон [CoF6] 3- парамагнитни. При образуването на йон [Co (CN) 6] 3- включващи силни поле лиганди (йон CN -) d- разделяне енергийни поднива ще бъдат толкова големи, че тя надвишава енергията на двойки електрони електрон-електронна отблъскване. Електроните ще запълни АД Co 3+ йон в нарушение на правило Hund (вж. Фигура 4). В този случай са сдвоени всички електрони, много йон - диамагнитно.
Пример 7. За йон [Cr (Н 2О) 6] 3+ енергия разделяне е 167.2 кДж мол -1. Какво е цветът на хромови съединения (III) във воден разтвор?
За определяне на оцветяване вещество определят дължината на вълната, при която абсорбцията на светлината
По този начин, йон [Cr (Н 2О) 6] 3+ абсорбира светлина в червената част на спектъра, което съответства на цвета на хром (III) в зелено.
Пример 8. установи дали сребърен сулфид утайка попада (I), при температура от 25 ° С, ако Смесват се равни обеми от 0.001 М разтвор на [Ag (CN) 2] -, CN- лиганд със същото име с концентрация от 0,12 мол / дм 3, и утаяване разтвор S2- йон при концентрация 3.5 х 10-3 М.
Метод за дисоциацията на йон може да бъде представен от схемата
и процес отлагане могат да бъдат написани като
2ag + + S 2- ↔ AG2 S¯,
За да се определи дали се образува утайка, е необходимо да се изчисли разтворимост продукта от сребърен сулфид ол (AG2 S) с формула
За да се определи концентрацията на сребърни йони напиши експресията на комплекс йон нестабилност константа
Чрез указател изберете постоянна стойност на нестабилността на комплекс [Ag (CN) 2] - (Knest = 1 х 10 -21). след това
Изчислете разтворимост продукта от получената утайка
.
Чрез указател изберете стойност маса на разтворимост продукта от сребърен сулфид (OL (AG2 S) Таблица = 5.7 х 10 -51) и да я сравни с изчислените такива. тъй PRtabl <ПРрасчет. то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
Пример 9. Изчислява се концентрацията на цинкови йони в tetratsianotsinkata натриев разтвор с концентрация от 0.3 мол / дм 3, с излишък на цианидни йони в разтвор, равна на 0,01 мол / дм 3.
Основната дисоциация се появява почти изцяло по схемата
Средно дисоциация е от уравнение
Ние пишете израза за константата на процес нестабилност
Чрез директория намери стойността на нестабилност постоянна йон (Knest = 1.3 х 10 -17). Концентрацията на цианидни йони, получени от дисоциация на комплекса, много по-малко концентрация въведена излишък и може да се приеме, че [КН -] »0,01 мол / дм 3 концентрация т.е. КН - йони. образувани в резултат на дисоциация, могат да бъдат пренебрегвани. след това
Енергийни и химични процеси. 3
Кратка теоретична информация. 3
Примери за решаване на проблеми. 10
Химически кинетика и равновесие. 17
Кратка теоретична информация. 17
Примери за решаване на проблеми. 22
Комплексни съединения. 28
Кратка теоретична информация. 28
Примери за решаване на проблеми. 39
Свързани статии
