Като установи броят на несдвоени електрони в COP, разберете степента на окисление на комплексообразуващ хибридизация неговите тип орбитали, а оттам и на пространствената структура.
Реактивност на Конференцията на страните, поради хибридизация с участието на външни г орбити и от присъствието на комдлексообразуващи безплатни "вътрешни» г орбити. COP външната хибридизация - SP 3 г 2 е по-реактивен отколкото COP с вътрешен хибридизация - г SP 2 3 (например, [Fe (Н 2О) 6] 2+ и [Fe (CN) 6)] 4-).
Разпределението на енергия на г - AO засяга комплекс стабилност: най-стабилната (при равни други условия) комплекси с пълни и половина пълни поднива.
По този начин, TAP обяснява много свойства на комплекси, свързани с попълването на електроните "вътрешен" г - AO: стабилност, топлината от реакцията, магнитните свойства; тя успешно прогнозира спектри (цвят) системи.
TAP е недостатъка, че се взема предвид лошото основен принос за енергийните връзки, обикновено като донор-акцептор природата. Поради това, едновременното използване на две теории - ФА и TAP - даде допълнителна информация.
Метод на молекулните орбитали (TMT) ви позволява да получите по-подробна информация за структурата и свойствата на комплекси (които, по-специално, обяснява спектрохимичната поредица, която прави TAP). Въпреки това, TMO е по-подходяща за висококачествени описания и оценки.
Така фокусни наречен химични съединения с различни видове и състояния на агрегиране със стабилни координационни лиганди около централната атом или йон, са образувани от прости изходни структури на възможните механизми за тяхното взаимодействие.
Комплексообразуването разширява възможния обхват на номера на валентност на свързванията се увеличава в резултат на участието на голям брой електрони и незапълнени орбитали.
7.2. Контролни въпроси и задачи
1. Състав KC: комплекс йон, централната атом, лиганди, координация броя на неутрален атом. вътрешната и външната сфера COP на.
2. Степента на окисление на комплексообразувателя и сложна таксата ИРА. Номенклатура COP. Име: а) К [AuBr4], б) Na3 [Ag (S2 О3) 2] а) [Cr (Н2 О) (NH3) 4 Br] Cl2. Посочва него външната и вътрешната примири комплексообразуващ агент, неговото окисление, за сметка на комплекс йон, лигандите.
3. Добави структурните формули на CS: tetraamminomedi нитрат (II), dibromotetraamminoplatiny хлорид (IV), amminopentahloroplatinat (IV) калиев tetratsianotsinkat (II) tetraamminomedi (II), trihlorotriamminokobalt. Какъв вид на всеки от комплексите?
4. Въвеждане на фокални следните съединения с формула: а) 3NaF · AlF3. б) NH4 Br · CuBr2 · 2NH3. а) CoCl2 · 4NH3 · Н2 О, Z) 2ба (ОН) 2 · Cu (OH) 2.
6. Какви видове хибридизация, наблюдавани в случай на образуване на CS? Дайте примери.
7. постоянна нестабилност и стабилност постоянна COP. Методи COP унищожение.
8. Използването на CS в медицината и фармацията.
Примери за решаване на проблеми
Пример 1. Определяне на заряд на броя на комплекс йонна координация (CN) и степента на окисление в комплексни съединения: а) К4 [Fe (CN) 6]; б) Na [Ag (NO2) 2]. Представено име съединение.
Решение. Зареждането на комплекс йон е равна на тази на външната сфера, но противоположни по знак. Номерът на координация е броят на лиганди. Степента на окисление се определя чрез комплексиране същите като степента на окисление на атом в всяко съединение.
Пример 2. Добави експресията на постоянен комплекс нестабилност [Fe (CN) 6] 4-.
Решение. Комплекс сол е силно електролит във воден разтвор дисоциира в йони необратимо външните и вътрешните области:
Комплекс йонна обратимо разграничи и в по-малка степен:
Този процес се характеризира с константа нестабилност на комплекса:
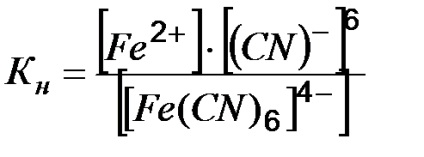
Колкото по-малко KH. на по-трайни комплекса.
7.4. индивидуални задачи
Задача 1. решаване на проблема на варианта (раздел. 47).
Опции контрол задача
Свързани статии
