При разглеждане на селективност халогенирането на алкани в предишния раздел, беше установено, че за всички процент халоген заместване на водород при въглеродния атом в ред намалява третичен> вторичен> първични, която е директно срещуположно на енергия интервала от С - H-връзки в алкани.
При сравняване на енергиите на първични и вторични връзки С - Н в пропан се вижда, че те се различават от 3 ккал / мол. Тъй като изходното съединение, и единият от Н • радикали същата тази разлика отразява само разликата в първични и вторични радикали стабилност. Подобна разлика в дисоциация енергията на изобутан (CH3) 3CH за (СН3) 2СН-CH2 • и Н • (98 ккал / мол) и дисоциацията на (CH3) 3C • и Н • (92 ккал / мол) отразява разликата в стабилност на първични и третични радикали. Той може да образува множество алкилови радикали относителната стабилност на базата на тези данни: алкилови радикали стабилност намалява в серия от третичен> вторичен> първичен. Дори по-висока стабилност притежават алил и бензилови радикали, като фенил и винилови радикали са по-малко стабилни от метилов радикал:
Промяната на стабилността на алкилови радикали обикновено се свързва с съвместното действие на два ефекта - giperkonyugatsii и етерични. Ако заместител радикал център е свързан с мезомерен ефект, стабилността на алкиловият радикал в значителна степен се увеличава. Когато този радикал се стабилизира като силен π-донор (например, - NH2), и силно π-акцептор (например, - ВН2) групи и заместители, улесняващи делокализация на несдвоени електрони (например, - СН = СН2) в алилов радикал. Стабилността на алкиловите радикали също засягат обемни фактори. Обикновено алкилови радикали са почти плоски частици, в които несдвоен електрон заема почти Нехибридизираната р-орбитален.
Например, в трет-бутил метилов радикал група отклонява от равнината на само 20 °. Следователно пространствен отблъскване между пълни електронен слой три метилови групи в изобутан значително ще отслабят дисоциационна връзка при С - Н:
Ако като мярка за стабилността на алкиловия остатък, ние избираме дисоциация връзка енергията на С - H в алкани, определен пространствен ефект ще бъде по-нататъшно стабилизиране giperkonyugatsii трет-бутилов радикал, в сравнение с метил.
Обикновено, свободни радикали алкил типичен димеризация или реакция на диспропорциониране на алкан и алкен. Например:
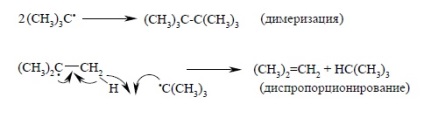
Тъй като и двете бимолекулна реакция, пространствени препятствия, които трябва да играят съществена роля. Следователно, разклонени алкилови радикали са по-малко склонни към смърт и в тези реакции.





Свързани статии
