Задача 2. Начертайте разпределението на електронната плътност
STI в молекули на следните съединения: а) 1-пропанол; б) etilboran; в) 2-metilpropenal; г) 1-бутен; г) 3,3,3-трихлорпропен; д) изопропиллитий; ж) 2-метокси-1-бутен; з) 1-нитро-1-бутен.
В молекули, които не съдържат полярни връзки, плътността на електрони е равномерно разпределена между атомите. Ако в молекулата поне една връзка е полярна, дипол връзка с това се компенсира с други електронни комуникации. Отводи на електронната плътност може да бъде причинена от действието на или индуктивен ефект на заместителя, или - в случай на конюгиране орбитали - мезомерен ефект.
Индуктивен ефект - така че с измествания на плътност електронни комуникации, причинени от близката полярна връзка. Той е обозначен с буквата I. В индуктивен ефект на С-Н произволно взета като равни на нула. Когато заместителят, който причинява изместване на електроните, привлича електрони повече от водороден атом, се приписва отрицателно индуктивен ефект (-I). В противен случай, когато заместителят отблъсква електронна плътност повече от водороден атом, положителен индуктивен ефект (+ I).
Мезомерни ефект - е възможността да се присъединят заместител орбита взаимодействие със съседния двойна връзка. Заместителите, които осигуряват взаимодействието на р-електрони под формата на свободна двойка (р, π- конюгация), т.е. допринесе електронна плътност в посоката на преместване на съседен проявяват множествена връзка + М ефект. Заместителите с полярен множествена връзка, влизат в пи, пи-взаимодействия (π, π-конюгация) с множествена връзка, която се отделя от него единична връзка, и изместват плътността електрон. Те притежават -M ефект.
Поляризация и полярни връзки и поляризиран в резултат на индуктивни и мезомерни ефекти връзки показват частични такси (δ- и δ +) в съответните атоми. Освен това, единични връзки за употреба стрелки по връзките, и за множествени връзки - извити стрелки на съобщение към съответния атом (или единична връзка, разделяне конюгирани множествени връзки).
Задача 3. Сравнение на размера на реакция на електрофилно
Освен следните съединения: етилен, пропен, 3,3,3-трифлуоропропен, 2-метилпропен.
Скорост електрофилни присъединителни реакции към въглерод-въглеродни двойни връзки или реактивност в реакции Ad Е. зависи от нуклеофилността на тази връзка. Нуклеофилността, т.е. способността да дарят електронна двойка, от своя страна, е пропорционална на електронната плътност в това отношение. Следователно, за сравняване на скоростта необходимо да се сравни ефекта на заместители (атоми и групи от атоми) в електронната плътност на двойната връзка, т.е. определяне на посоката и относителният размер на техните електронни ефекти.
СН 2 СН 2 СН 3 СН СН 2 СН 2 СН CHCF 3 С СН2
Молекулата на етилен с двойна връзка на въглеродните атоми свързан само водородни атоми, които индуктивен ефект приема да бъде 0. Следователно, молекулата на етилен могат да се разглеждат като стандарт, срещу които може да се позиционира
в броя на всички други връзки.
експонати молекулата пропен метилова група + I-
ефект, т.е. Това е заместител, който увеличава плътността на електрони при двойната връзка и следователно повишава реактивоспособността на пропен в реакцията на електрофилно допълнение, в сравнение с капацитета на етилен.
Още по-реактивоспособна от етилен и пропен, 2-метилпропен е. защото молекула има два електрон-отдаваща заместител двойна връзка.
В молекулата на 3,3,3-трифлуоропропен три флуорни атома, поради тяхната по-голяма Електроотрицателност сравнение с атом показват въглеродния -I ефекти, които причиняват въглеродния атом, към който те са свързани голям недостиг на електронната плътност. Това прави трифлуорометил силно електрон акцептор. Ето защо, 3,3,3-трифлуорпропен деактивира за електрофилно присъединяване, т.е. и да е причина
giruet с електрофилни реактиви значително по-бавно от етилен.
Така, тези съединения могат да бъдат подредени в ред, за да се увеличи реактивоспособността в реакции
3,3,3-трифлуоропропен <етилен <пропен <2- метилпропен.
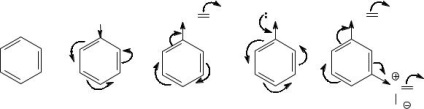
Задача 4 може да се сравни реактивността на следното
съединения в електрофилни реакции на заместване: бензол, толуол, бензалдехид, фенол, мета - нитробензалдехид.
Реактивността на ароматни съединения в електрофилни реакции на заместване зависи от тяхната нуклеофилност - способността да дари електронна двойка, която зависи от общата електронна плътност на ароматно ядро. Заместителите електрон okazyvyuschie действие на ароматно ядро, увеличена електронна плътност върху него и по този начин повишаване на реактивността на съединенията, т.е. активирате тях да електрофилно атака. Електрон привличаща заместители, намаляване на електронната плътност на ароматния пръстен, в качеството на дезактивиращи заместители. Следователно, за да се сравни реактивността на необходимостта да се определи естеството на заместителите, да се идентифицират всички електронни ефекти, които специфично се отразява на заместник ароматен пръстен.
Молекулата на толуен метилови заместители експонати + I-ефект, т.е. Това е донор на електрони. Следователно, в сравнение с толуен бензен съединение се активира и реагира с електрофили бързо.
Молекула бензалдехид дезактивира с електрофилно заместване като формилова група е електрон-отнемане заместител (деактиватор) проявява по отношение на бензеновия пръстен и -I- и -M ефект.
Още по-деактивиран от бензалдехид, е мета - нитробензалдехид. тъй като в допълнение към групата на електрон-формил в молекулата и все още представляват силно деактивиращ заместител като нитро (-I- и -M ефект).
Най-активното съединение е фенол. хидроксилна група, която, въпреки -I ефект, оказва силно въздействие върху цялостната електрон ароматен ядрото чрез много ефективен р-π- конюгиране (М + >> - I).
По този начин, тези съединения са подредени по следния възходящ реактивността на електрофилни реакции на заместване:
мета -nitrobenzaldegid <бензалдехид <бензен <толуен <фенол.
Задача 5. Сравнете киселинни свойства следните soedi-
neny: а) метан и нитрометан; б) етанол и 2-хлороетанол; в) метанол и метиламин; г) оцетна киселина и ацетон; г) етанол и фенол. Обосновете отговора си.
Киселинните свойства съгласно теорията Bronsted проявява в способността на съединенията да влиза в обратим взаимодействие с протонен акцептор - база - конюгат основа до образуването на конюгат база и киселина се определя и позицията на това равновесие. Колкото по-силна равновесието се измества надясно, толкова по-силно киселинни свойства. Сравнете киселинните свойства на различни киселини може да бъде качествено чрез сравняване на позицията на алкално-киселинното равновесие на тези киселини с всяка база. Позицията на равновесие зависи от относителната стабилност на основата конюгат, така че за сравнение на свойствата на различни киселинни съединения, необходими за оценка на стабилността на базите конюгат. Колкото по-стабилна свързана база,
така че е по-слаб и следователно толкова по-силен sootvetst-
vuyuschaya киселина. Стабилността на конюгатни основи, които са за киселини, които имат не отговаря отрицателно заредени частици - аниони засягат както вътрешномолекулни фактори и външни фактори, като например, солватиране. Ако разтворителят не е определено, като се има предвид зависимостта на стабилността на конюгатни бази само от вътрешни фактори, които включват първи електронни: а именно, способността на съседните атоми и групи стабилизиращи на отрицателно заредени частици. Това може да бъде отрицателно индуктивен ефект на заместител, който намалява отрицателен заряд поради свиване на електронната плътност, или отрицателен ефект мезомерен показателно за делокализация на електронната плътност и отрицателен заряд.
а) метан и нитрометан
Това показва алкално-киселинното равновесие за тези съединения с някоя база (В).
Следователно, нитрометил анион е по-стабилен от метил анион. Следователно нитрометан е силна киселина от метан. Всъщност, нитрометан като киселината е повече от 30 порядъка по-силен от метан.
б) етанол и 2-хлороетанол
В молекули етанол и 2-хлороетанол има различни водородни атоми, но свойствата на киселини на тези съединения се дължи на присъствието на хидроксилната група O-H като киселина, са по-мощни от С-Н-киселина (способност атоми носят отрицателен заряд в зависимост от тяхната позиция в периодичната таблица за периода се увеличава от ляво на дясно). Следователно, алкално-киселинното равновесие на тези съединения са както следва:

СН3 СН2 О Н + ВСН 3 СН 2О + Н B
СН 2 СН 2 О Н + ВСН 2СН 2О + Н B
2-Hloretoksid анион по-устойчив от етоксид анион като хлорен атом, развиваща -I ефект, издърпва електронната плътност на а-връзки, намаляване на плътността на електрони на кислородния атом и по този начин отслабва алкалността. Следователно, 2-хлороетанол силна киселина от етанол.
в) метанол и метиламин
О-Н-киселина, като N-Н-киселина е по-силна киселина от С-Н киселина така че алкално-киселинното равновесие на метанола и метиламин са както следва:
CH 3 NHH + ВСН 3 NH + B Н
Methoxide анион е по-стабилна частиците от метиламид анион защото повече електроотрицателна кислороден атом лек "притежава" отрицателен заряд, по-малко електроотрицателна азотния атом. Следователно metoksidanion конюгат е по-слаба база от анион-метиламид и метанол - по-силна киселина от метиламин.
г) оцетна киселина и ацетон
На алкално-киселинното равновесие на оцетна киселина и ацетон, както следва:
Свързани статии
