Цикличните конюгирани системи са от голям интерес като група от съединения с повишена термодинамична стабилност в сравнение с сдвоени отворени системи. Тези съединения имат други специфични свойства, които заедно се обединяват обща концепция на ароматност. Те включват способността на официално ненаситени съединения да влиза в реакция на заместване, отколкото свързването на действието на окислители и температурна устойчивост.
Типични представители са ароматни системи на арена и техните производни. Характеристики на електронната структура на ароматни въглеводороди са ясно проявяват в атомна орбитална модел на молекулата на бензен. бензен форма скелет шест -gibridizovannyh SP 2 въглеродни атома. всички # 963; -връзките (С-С и С-Н) лежат в една равнина. Шест не-хибридизира р-AO молекули са разположени перпендикулярно на равнината и успоредни един на друг (Фиг. 3a). Всяко р AOS може също така да се припокриват с двете съседни р AOS. В резултат на припокриването е единична делокализирана π-система, най-високата плътност на електрони, което е над и под равнината # 963; -skeleta цикъл и обхваща всички въглеродни атоми (виж фигура 3b ..). π-електронна плътност се разпределя равномерно в пръстенната система, както е посочено в фантом кръг или в една линия (вж. фиг. 3в). Всички връзки между въглеродните атоми в бензеновия пръстен са с еднаква дължина (0.139 пМ), междинно съединение между дължините на единични и двойни връзки.
Въз основа на квантовата-механични изчисления е установено, че образуването на тези стабилни молекули плосък пръстенна система трябва да съдържат (4п + 2) пи-електрони, където п = 1, 2, 3 ,. D. (на Huckel правило. 1931). С понятието "ароматна структура" можете да определите с оглед на тези данни.
Ароматни системи (молекули) - системи, които отговарят на критериите на ароматност:
1) Наличие на плосък # 963; -skeleta състояща се от SP 2 -gibridizovannyh атома;
2) делокализация на електрони води до образуването на един π-електронен облак ЛИЗАЦИЯ, обхваща всички атоми на цикъл (и);
3) E. на Huckel правило съвпадение, т.е. общо електронен облак трябва 4п + 2 пи-електрони, където п = 1,2,3,4 ... (обикновено номер показва броя на циклите в молекулата);
4) висока степен на термодинамична стабилност (висока енергия на свързване).
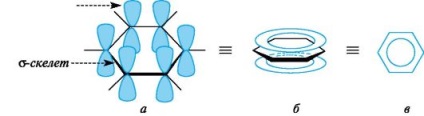
Фиг. 3. атомна орбитална молекула модел бензен (водородни атоми са пропуснати, обяснението в текста)
Стабилност на спрегнати системи. Образуването на конюгата, и особено ароматна система - енергично благоприятен процес, тъй като това повишава степента на припокриване на орбитали са делокализирани и (дисперсия) р-електрони. В тази връзка, конюгирана или ароматна система са се увеличили термодинамична стабилност. Те съдържат по-малък резерв на вътрешна енергия в основно състояние и заемат по-ниско ниво на енергия в сравнение с не-спрегнати системи. По разликата на тези нива могат да бъдат количествено чрез термодинамичната стабилност на конюгираното съединение, т. Е. му свързване енергия (енергия делокализация). Към 1,3-бутадиен е малък и е около 15 кДж / мол. С увеличаване на дължината на конюгиран верига и съответно енергията на сдвояване термодинамична стабилност на увеличенията на съединенията. Енергия за конюгиране на бензен е много повече и е 150 кДж / мол.
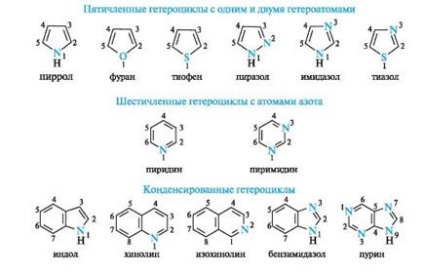
Примери nebenzoidnyh ароматни съединения:
Пиридин електрон структура наподобява бензол. Всички въглеродни атома и азотния атом, са в SP 2 хибридизация и всички # 963 (. Фигура 4а) -връзките (С-С, С-N и С-Н) лежат в една и съща равнина. От трите хибридни орбитите на двата азотни атома, които участват в образуването
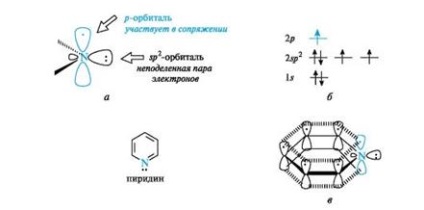
Фиг. 4. пиридин азотен атом (и), разпределението на електроните в орбитали (б), и конюгирания система в молекула пиридин (а) (С-Н са пропуснати за опростяване на чертежа)
# 963; -връзките към въглеродните атоми (само осите на тези орбитали) и третият съдържа свободна двойка електрони орбитални в образуването на връзка не е включен. с азотен атом електронна конфигурация по пиридина на.
Поради електрона намира на хибридизираните р орбитали (вж. Фиг. 4Ь), азотен атом, участващи в образуването на един електронен облак от електрони вж пет въглеродни атома (вж. Фиг. 4с). Така, пиридин е π, π-конюгиран система и критериите за ароматност.
В резултат, по-голям Електроотрицателност сравнение с въглеродния атом на пиридиновия азот понижава плътността електрон на въглеродните атоми на ароматния пръстен, следователно система с пиридин азотен атом се нарича π-дефицитни. Освен пиридин, пример на такива системи е пиримидин, пиридин, съдържащ два азотни атома.
Пирол също така се отнася до ароматни съединения. въглеродни и азотни атоми в тях, например в пиридин, в състояние sp2-хибридизация. Въпреки това, за разлика от пиридин азотен атом в пирола има различна електронна конфигурация (фиг. 5а, б).
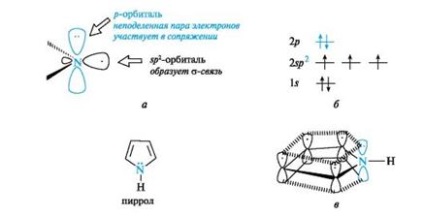
Фиг. 5. пирол азотен атом (и), разпределението на електроните орбитали (В) и конюгирани система пирол молекула (в) (С-Н връзки са пропуснати за опростяване на чертежа)
На Нехибридизираната р атомна орбитална на азот е неразделен двойка електрони. Той участва в свързване с р -elektrona- мл четири въглеродни атома, за да се образува равномерен облак shestielektronnogo (вж. Фиг. 5с). Трите SP 2 орбитали формата три -Hybrid # 963; -връзките - два въглеродни атома, един водороден атом. Азотният атом в този електронен състояние, наречено пирол.
Shestielektronnoe облак пирол поради р, п -conjugate делокализирани на пет атома в пръстена, така пирол представлява π-съкратени система.
В фуран и тиофен ароматен секстет включва и неразделен двойка електрони нехибридизираните р-AO кислород или сяра, съответно. На имидазол и пиразолови два азотни атоми правят различни принос за образуването на делокализиран електронен облак: пирол азотен атом доставя двойка пи-електрони, и пиридин - един р-електрон.
Също така има ароматност пурин представлява система от два кондензирани хетероцикли - пиримидин и имидазол.
Делокализирани електрони облак в пурин включва 8 пи-електрони на двойните връзки и свободна двойка електрони на атома N = 9. Общият брой на електроните в конюгация равен на десет съответства на формула на Huckel (4п + 2, където п = 2).
Хетероциклични ароматни съединения притежават висока термодинамична стабилност. Не е чудно, че те са структурните звена на най-важните биополимерите - нуклеинови киселини.
