Реакциите се провеждат в електролитни разтвори между йоните, които са дисоциирани разтворени вещества. Това не променя степента на окисление на елементите.
Не всички йонообменни реакции са необратими. обменни реакции на йони са оставени в случай, образуван от реакцията:
-неразтворимо съединение се утаява;
-слаб електролит (вода, слаба база или слаба киселина).
-- Реакциите от този тип е по-правилно да напише не е в молекулното и йон-молекула форма. В тези уравнения посочва йони, които разграждат молекулите на силни електролити. Слабо разтворими вещества, отделяни от разтвора като утайка, газообразни съединения и слаби електролити в тези уравнения са написани в молекулна форма. Освен това, има кратка форма на йонна реакция уравнение показва същността на реакцията срещащи се в електролитен разтвор.
Примери на реакции, проявяващи необратимо
1. Процесът на утаяване
- молекулна реакция уравнение,
Ба 2+ + 2Cl - + 2Na + + SO
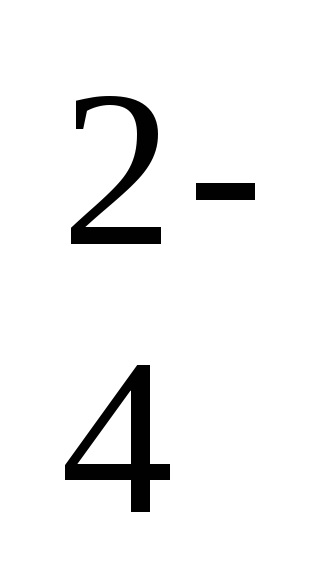
- -ionic реакция уравнение,
Ба 2+ + SO
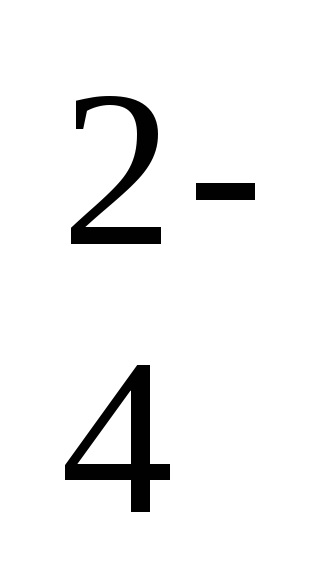
2. Образуване на газообразно вещество
- молекулна реакция уравнение,
2Na + + S 2- + 2Н + + 2Cl - = Н2 S ↑ + 2Na + + 2Cl -
--ionic реакция уравнение,
2Н + + S 2- = Н2 S ↑ - уравнение реакция кратка форма.
3. слаби електролити Образование
а) Вода: 2NaOH + H 2SO 4 = Н 2О + Na 2SO 4 - уравнение молекулна реакция,
2Na + + 2ОН - + 2Н + + SO
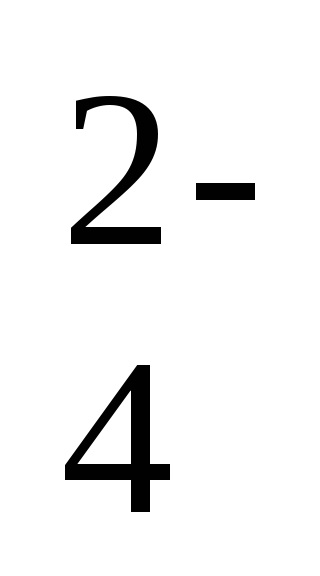
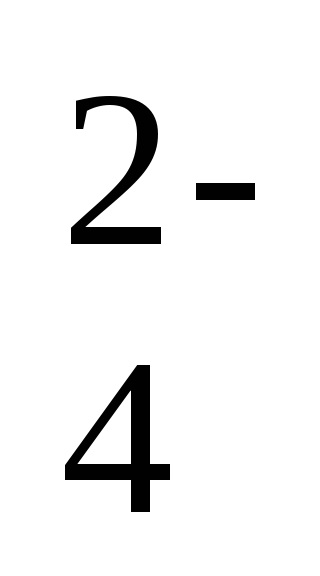
--ionic реакция уравнение,
2ОН - + 2Н + = 2Н2 О - уравнение реакция кратка форма.
Неутрализация реакция на силна киселина със силна основа, се редуцира до взаимодействието на водородни йони с хидроксилни йони.
б) слаба киселина:
- молекулна реакция уравнение,
2Na + + 2NO2 - + 2Н + + SO
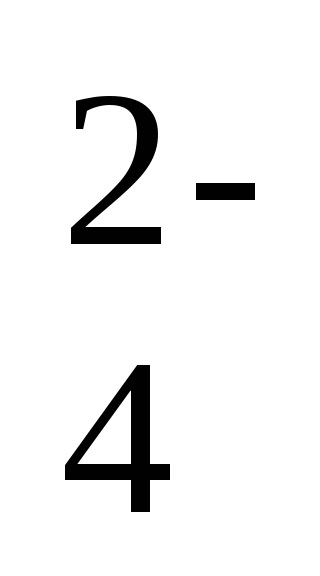
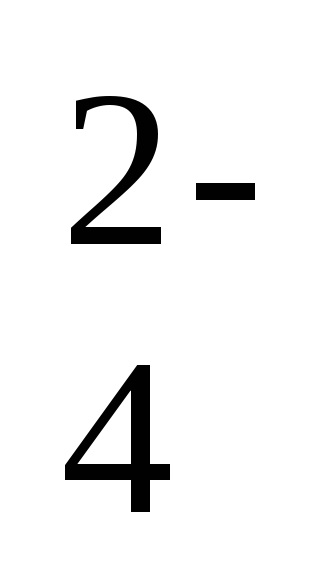
--ionic реакция уравнение,
2Н + + 2NO2 - = 2HNO2 - реакция уравнение кратка форма.
Силни киселини изместват слаби киселини от техните соли.
в) слаба основа:
На NH4CI + NaOH = NH4 OH + NaCl
- молекулна реакция уравнение,
NH4 + + Cl - + Na + + OH - = NH4 OH + Na + + Cl -
--ionic реакция уравнение,
NH4 + + OH - = NH4 OH - образува кратко уравнение реакция.
Силни основи изместват слаби бази от техните соли.
амфотерни хидроксиди
Амфотерните хидроксиди - водонеразтворим съединения като М (ОН) п. които взаимодействат както с разтвори на киселини и основи с. В отговор на киселинни разтвори, те проявяват основните свойства:
Взаимодействие с основи, те имат киселинни свойства, докато съединения, образувани gidroksokompleksnye:
разтворимостта на продукта
Абсолютно никакви неразтворими вещества. Повечето от твърдите частици имат ограничена разтворимост. Наситените разтвори на електролити умерено разтворими вещества в състояние на динамично равновесие и утайка са наситени електролитен разтвор. Например, в наситен разтвор на бариев сулфат в контакт с кристали на веществото, динамично равновесие: BaSO 4 (R) ⇄ Ba 2+ (п) + SO
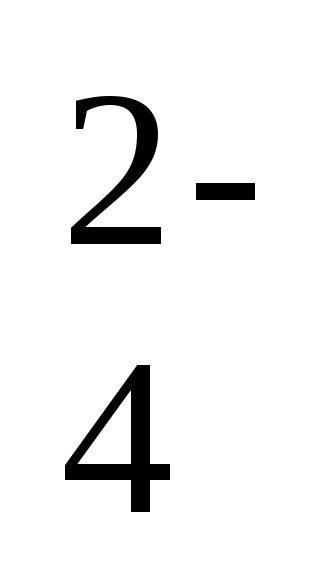
За този процес равновесие може да напише равновесната константа експресия, тъй като концентрацията на твърдата фаза не е включена в експресията на равновесните константи: Кр = [Ba 2+] [SO
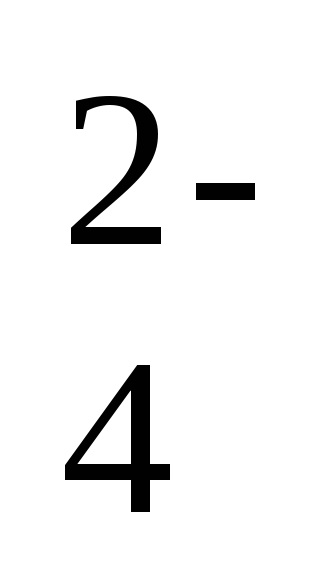
Тази стойност се нарича разтворимост продукт на слабо разтворимата субстанция (OL). По този начин, в наситен разтвор на слабо разтворима съединение продукта от неговите йонни концентрации в степен стехиометрично коефициент равен на продукта за разтворимост. В този пример, PR (BaSO 4) = [Ba 2+] [SO
Свързани статии
