Фиг. 52 показва изотерми газ Ван дер Ваалс сили.
При много високи температури, че имат форма близка до хиперболи; Тези изотерми характеризират газообразно състояние на дадено вещество (почти идеален газ). Чрез намаляване на температурата и промяна на формата на изотерма при определена температура (критичен) открива инфлексна точка на кривата. В още по-ниски температури (подкритично) изотерма вместо хоризонталната част, съответстваща на течност фазов преход - пара, има вълнообразна част (Фигура 53)..
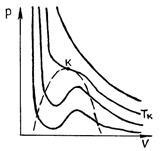
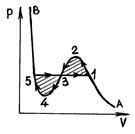
Р и Р. 52 Р и С. 53
Измерванията показват, че изотерми реално вещество по същество съвпада с изотерма на ван дер Ваалс сили в областта (в газообразно състояние) и (втечни). Въпреки това, вместо през центъра на хоризонталната част 51, съответстваща на фазовия преход на течността - пара изотерма Ван дер Ваалс има вълнообразна част. Това вълнообразна част се характеризира както следва. Парцел 12 съответства на метастабилни състояние на пара (наситена пара), част 54 - като метастабилни течност (прегрята течност). В точка 1 е просто наситена пара, и при 5 - само кипяща течност. По отношение на вълната част 234, е физически неосъществима, тъй като в природата вещества, за които при увеличаване постоянна температура би довело до увеличаване на налягането. Това е възможно само ако температурата в тази област не е постоянен. В свръхнаситена пара (част 12) - газообразно състояние на материята в която р на налягането е по-голямо от налягането на наситената пара при дадена температура - може да бъде експериментално получени чрез пресоване на продухване газ при налягане по-голямо от налягането на наситената пара, и няма да се кондензира. Състояние на свръхнаситена пара, въпреки че има известна стабилност, но е по-малко стабилен от състоянието двуфазна (Isobar 135), в който, както знаем, някои от веществото е в течна форма, и част - под формата на наситена пара. Следователно, когато малка външна сила свръхнаситена пара частично се превръща в течен и оставащото пара се насища.
Прегрята течност (точка 45), - състояние, характеризиращо се с това, че той съществува при налягане по-ниско от налягането на парите при дадена температура - могат да бъдат получени от удължено кипене чиста течност, в резултат от течни отстранява газови мехурчета (изпаряване центрове), и течността се нагрява до температура над точката на кипене при дадено налягане. Състояние прегрята течност е по-малко стабилен от състоянието на равновесие между течността и наситената пара. Ако в такава прегряване течност да влезе частиците на чужди тела, а след това се движи бързо в своята двуфазен състояние.
Постоянен наситена пара и прегрята течност, използвана в устройства за ядрена физика (облак камера и камера балон) за регистриране и измерване на параметрите на частиците.
Ако изотерма Ван дер Ваалс вълнообразна част да замени хоризонтална линия 135, тогава изотерма се получава както ще бъде качествено правилно описват и двуфазна състояние материал. Позицията на тази линия може да се определи, ако затворен обратим цикъл 1234531 втория закон на термодинамиката прилага за запис Клаузиус (2.13.7):
Тъй като по протежение на температурата на веществото начин 1234531 остава същата (защото този път е съставен от части от два възможни варианта на една и съща изотерма), последното уравнение може да се запише като
Заместването на стойността на съотношението на първия закон на термодинамиката и факта, че
получаваме за разглеждания цикъл:
Нека да направим последната равенство очевидно е трансформация
т. е. хоризонтална линия 135 нужда да се харчат така че излюпени на фиг. Площ 53 са равни.
Както вече бе отбелязано, критичната точка изотерма има инфлексия допирателна и поради това в този момент трябва да се извършва съотношения
където влизане показва, че съответните производни са изчислени за веществото от стойности на параметри равно критично. Писане уравнението на ван дер Ваалс сили в
след изчисляване на производни и ги приравнява на нула, ние можем лесно да се получи
От изразите (3.6.8-3.6.10), че съотношението
Тя не зависи от естеството на веществото. Опитът показва, че величината има различни стойности за различните газове, е равна на 0.33 водород с кислород - 0.29, за въглероден диоксид - 0.22. Тези съществени разлики ценности и експериментални данни показват, че Ван дер Ваалс сили, от които се получава тази стойност приблизителна, въпреки промени в качеството на картината на състояние на материята, се предава чрез уравнението доста добре. Голяма част от опитите да се получи по-точна уравнение на състоянието. Въпреки това, тези уравнения съдържат голям брой коригиращи фактори, физическото смисъла на които е ясно, както в уравнението на ван дер Ваалс сили.
В най-общата форма на методите за статистически физика Академик Bogolyubov уравнение на състоянието се получава
където - така наречените virial коефициентите, които са функции на температура. От Bogolyubov уравнение, че по-голяма е стойността на моларен обем. трябва да се обмисли по-малък от броя на мандатите, за да се получи достатъчно точен резултат. Когато всички членове на степенния ред са равни на нула, а уравнението (3.6.12) е под формата. .. Това е, както може да се очаква, уравнението Боголюбов се трансформира в уравнението на Менделеев - Клапейрон. Virial коефициенти не могат да бъдат изчислени чисто теоретични методи и следователно трябва да се определят от експериментални данни. Въпреки това, този проблем е толкова сложна, че е по-подходящо да се осигури просто уравнение на състоянието, в формата на формула интерполация, която описва експерименталните данни.
Свързани статии
