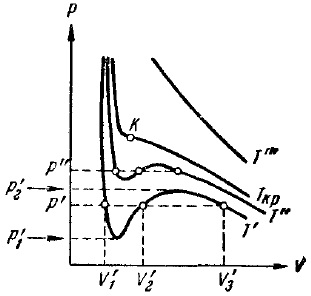
Фигура 9. Изотермите на ван дер Ваалс
Фиг. 9 показва изотермите на ван дер Ваалс принуждава няколко температури. Когато температурата Т "idavleniyah в p'1 с Р2 коефициентите в (32), така че всичките три уравнения са истински разтвори; в друг натиск, ще бъде само едно реално решение. Разликата между трите реални решения на уравнението намалява температурата се покачва (вж изотермите Т 'и Т "и Т"> T.). От известно, за всяко вещество от тяхната температура Тсг по всяко налягане има само един истински разтвор на уравнение (32). Той призова критичната температура Тсг. Ако се повиши температурата, точката, съответстваща на решенията на уравнението V'1. V'2 и V'3 са все по приближаващ, сливане на критичната температура в един посочен на фиг. 9 писмо К. К се нарича критичната точка. За съответния изотерма К е инфлексната точка. Нейният съвпадат три съвпадение реални решения на уравнението (32). Допирателната към критичната изотерма в точка К е границата, към който са склонни сечащ р ', р "и т. Г. Тъй като температурата се доближава до критичната стойност. Следователно, тази допирателна като всички secants успоредна на оста V, производното на точка К е нула. в допълнение, инфлексната точка трябва да бъде нула секунди производно.
За да се получи изотерма експериментално, че е необходимо да се вземе въпроса в газообразно състояние, го поставя в контейнер с подвижно бутало (фиг. 10) и да започне бавно за компресиране, което едновременни измервания на налягане и обем, както и се гарантира, че температурата на веществото остава постоянно , Резултатите от тези експерименти до под критичната температура са дадени на фиг. 11. Първо, с намаляване на обема на увеличения налягане газ, ходът на изотерма е доста добре описан от Van дер Ваалс сили. Въпреки това, като се излиза от обема определена стойност Vz. експериментален изотерма престане да следва уравнението (31). Като се започне от тази стойност, обемът, налягането в съда престане да се промени, самото вещество така престава да бъде хомогенен: част от газа се кондензира в течност. Това се извършва, както се казва, сноп от вещество в две фази: течни и газообразни. Като допълнително намалява все повече и повече на веществото в течна фаза, при което преходът се извършва при постоянно налягане, показано на фигура rn.p.
Фигура 10. Устройство за получаване на експериментални изотерми
След процеса на кондензация вещество завършва в течност (това се случи, когато обемът VI), допълнителни започва намаляване на обема придружени от бързо повишаване на налягането. В този случай, по време на изотермите над приблизително следното уравнение (31). Веществото в страните, съответстващи на тази част от изотерма, отново ще бъдат еднакви, но не е газ, като течност.
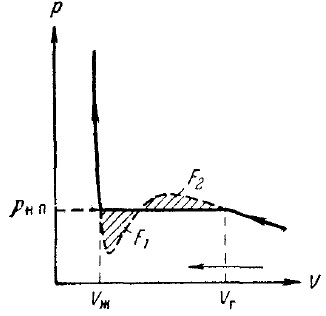
Фигура 11. Изотерма на недвижим газ
По този начин, уравнението на ван дер Ваалс описва не само газообразно състояние на вещество, но също така обхваща метод на преминаване към течно състояние и процеса на компресиране течност.
Сравнението на експерименталната изотерма изотерма Ван дер Ваалс предвижда, че тези изотерми съвпадат доста добре в области, които отговарят на еднофазни състояние на материята, но се държат по съвсем различен начин в разделянето на две фази. Вместо S-образна извиване изотерма Ван дер Ваалс експериментален изотерма в тази област има хоризонтална праволинейна част, която е разположена така, че зоната, обхваната от прегъвката F1 и F2 (фиг. 10) са идентични.
Състоянията, съответстващи на хоризонталните изотермите секцията наблюдавани равновесие между течни и газообразни фази на веществото. Газ (или пара) в равновесие с течност се нарича наситен пара. RNP налягане, при което може да съществува равновесие при дадена температура, наречен налягане (или еластичност) на наситена пара.
Тегловното съотношение на течност и пари в двуфазна състояние е съотношението на сегментите за която разделя хоризонтална точка част изотерма представляваща състояние.
Фиг. 12 показва експериментални изотерми на няколко температури. Както се вижда от pisunka с повишаване на температурата изотерма хоризонтален участък е намалена, теглене точката на критичната температура Тсг. Съответно, намалява разликата в определени части и следователно плътността на течността и парата. В критичната температура, тази разлика изчезва напълно. Едновременно изчезва разлика между течност и пари.
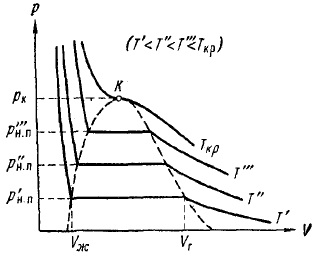
Ris.12.Eksperimentalnye изотермите за същия газ при различни температури
Фиг. 12, който увеличава налягането на парите с температура, достигайки критичен PCR точка стойност. PH зависимост. п на температурата е дадена на фиг. 13. Кривата завършва в критична точка, тъй като при температури над критичната понятие пара губи значение. Крива започва в така наречената тройна точка Tr. Кривата на фиг. 13 представлява мястото на точки (налягане и температура), които са в равновесие, течността и газообразни фази. Тройната точка - това равновесие точка на три фази: твърди, течни и газообразни.
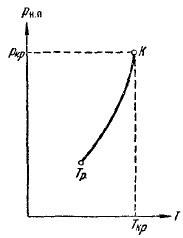
Фиг. 13. Зависимостта на парното налягане от температурата
Ако се направи линия през крайните точки на хоризонталните участъци на изотермите (фиг. 12), се оказва, кривата на камбана, ограничаващ района на двуфазни състояния на материята. При температури над критичното налягане за всяко вещество, е хомогенна. При тези температури, без компресия, не може да се осъществи втечняване агент.
Концепцията на критичната температура е въведена първо в Менделеев 1860, Менделеев нарича абсолютна температура на течността на кипене и Ras разглежда като температурата, при която силата на адхезия изчезва между молекулите и течността се превръща в пара, независимо от налягането и обема заема ,
камбанка крива участък и критичната изотерма, който се намира в ляво от точка К, се разделят на диаграмата (р, V) в три области (Фиг. 14). Косо област люпене белязан хомогенни течни състояния на материята. Под кривата на камбана е, както знаем, районът на състоянието на две фази, и най-накрая, област, намираща се в дясно на кривата на формата на камбана и горната клон на критичната изотерма, е регион на хомогенна газообразно състояние на материята. В последния можете да откроите частта, която се намира под дясната клон на критичната изотерма, наричайки го няколко области. Всяко състояние в този регион се отличава от други газообразни държави, в смисъл, че при изотермични компресия вещество е първоначално в процес на държавно подложени на втечняване. Вещество в състояние над критичната температура, не може да бъде втечнен чрез компресия. Разделението на газообразни състояния на газ и пара не се приема от всички.
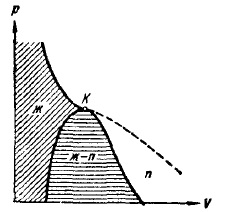
Фиг. 14. Три области на недвижими газ състояние
Чрез избиране на прехода, така че да не се пресича региона на двуфазен, е възможно да се направи преход от течност в газообразно състояние (или обратното) без разслояване материал в две фази. В този случай, материалът преход по всяко време ще остане единна.
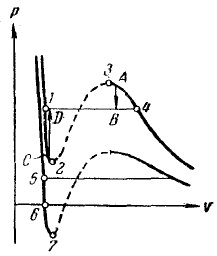
Фиг. 15. метастабилни държави
От сравнението на изотермите Ван дер Ваалсови сили с експерименталната изотерма ние открихме, че вместо S-образна извиване -3 -4 1-2 (фиг. 15) Най експериментален изотерма 1-4 има праволинейна част, съответстваща на състояние материал двуфазна. Това се дължи на нестабилността на хомогенни състояния отговарящи на гърча 1 -2 по 3-4. Нестабилността състояние в района на 2 -3 става ясно, като се има предвид, че в тази област производната е положителна. Следователно вещество, способно да премине последователност на състояния 2 -3, ще притежават доста неестествени свойства: повишен обем на газ не се придружава от намаляване и увеличаване на налягането.
В районите, 1-2 и 3 -4 е отрицателен, така че, на пръв поглед, тези области може да се реализира. Наистина, щатите, съответстващи на тези секции могат да се извършват в съответствие с известни условия. Въпреки това, те не са много стабилни: достатъчно е, например, може да хит в двойки сламката че цялата материя се разделя на две фази и се прехвърля в състояние В (виж стрелка показва преход А -> В на Фигура 15 ..). Това не са съвсем стабилни състояния се наричат метастабилни. Веществото се нарича в държави 1-2 прегрята течност вещество в държави 3 -4 наречен свръхнаситена пара.
Свързани статии
