За да се изследва поведението на реален газ изотерми считат ван дер Ваалс на - криви от при дадените температури Т определят от уравнението на ван дер Ваалс сили за 1 мол на газ (фигура 9.2.). Тези криви се считат за четири различни температури. При високи температури, изотермите на недвижим газ се различава от идеалните газове изотермите само някои изкривяване на формата си, пребиваващи монотонна крива. При определена температура в изотерма има инфлексна точка К. Това се нарича критичната изотерма, съответната температура - критичната температура. и точка K - критичната точка. Държавата с най-критичните параметри се нарича критично състояние.
При температури имат вълнообразна част от изотермите. В реални изотерми на извивката не е, вместо те имат прав и равен участък (фиг. 9.2 пунктирани линии). Ако от крайните точки на хоризонталните участъци на изотермите на семейството, за да удържи фронта, можете да получите крива звънец очертаващ района на двуфазни състояния на материята. Тази крива и критичната изотерма разделение P графиката, V съгласно изотерма в три области: крива камбана е региона на условия двуфазни (течност и наситен пара F + р), от ляво на него има площ от течно състояние (F), а дясната - двойката област ( P). Парна различава от други газообразни посочва, че претърпява изотермични компресия, процес на втечняване. Газ и над критичната температура не може да се трансформира в течност под налягане не.
2. метастабилни държави (Gk мета -. След, за, в този случай за стабилно състояние, нестабилна държава).
Помислете страна на изотермите на фиг. 9.3. Състоянието на площ 2-3 не се прилагат, както върху него. т.е. увеличаване на обема на газ ще бъде придружен от не спад, и повишаване на налягането - доста неестествено собственост. В районите, 1-2 и 3-4. това е нормално, но се оказва, че тези състояния не са напълно стабилни. Достатъчно е в състояние на прахови частици, влизащи в пара за материал се разпада на две фази и се пренасят в състояние В. (припомни, че фаза се нарича хомогенна, идентичен на свойствата на системата. Например, вода в затворен съд и сместа от въздух и водна пара. Парата, vravnovesii разположен с течност nazyvaetsyanasyschennym.
Налягането, при което се наблюдава равновесие се нарича налягането на наситената пара). Членка, подобен на A (нестабилна) се наричат метастабилност. Състояние 1-2, където налягането е по-ниска при дадена температура се нарича прегрята течност. и 3-4
() - свръхнаситена пара. Помислете за състоянието на пренаситен пара. За формирането на течни капчици трябва конвергенция молекули от порядъка на разстоянието между молекулите в течността. Това изисква присъствието на кондензационни ядра (прахови частици заредени частици, течни капки). камера облак (британски учен, 1927 Нобелова награда.) въздух, наситен с водни пари бързо се разширява и съответно се охлажда. Двойките са в състояние на насищане. Ако заредена частица получава в камерата, парата се кондензира върху него в малки капчици, образува видим знак ( "песен") по време на своето движение.
Помислете за прегрята течност. Ако течността се почиства основно на твърди примеси, след това чрез нагряване или налягане намаляване преди да може да се преведе в състояние на прегряване. Преминаването на заредени частици води до образуването на частици по пистата кипене зародишни центрове. фотографирани Bubbles.
Нека разгледаме състоянието на т. К (фиг. 9.2.). В този момент разликата в плътностите на течност и пари изчезва напълно. Едновременно изчезва разлика между течност и пари. Интерфейсът между течност и пари също не. Първата и втората производни на налягането в обем са нула.
3. вътрешната енергия на реален газ. Освен кинетичната енергия съдържа потенциалната енергия на взаимодействието между газови молекули. Работата по време на разширяването на газ срещу силите на привличане на молекулите една спрямо друга, равни на нарастване на енергията на взаимодействие. Ван дер Ваалс корекция на налягането. След това работата. следователно потенциалната енергия
Когато реален газ се ангажира с идеала, а след това:
Преди за се получава кинетичната енергия на случаен топлинна движение на молекулите :.
На вътрешната енергия на реален газ, като се вземат предвид както кинетичната и потенциална енергия:
Това означава, че на вътрешната енергия на молове ван дер Ваал газ е функция на състоянието на газ.
4. ефект на Джаул-Томсън
Джаул - температура газ Thomson се променя в резултат на адиабатно Дроселирането - бавен поток газ под постоянно диференциално налягане през дроселираща препятствие (например, пореста мембрана р - дросел на Фигура 9.4.). Терминът "адиабатно" означава без никаква топлообмен с околната среда. Адиабатичната може да се осъществи например чрез топлоизолиращи обвивка около канала. при
преместване на буталото (P) образува постоянно диференциално налягане (). Разграничаване а) положителен ефект за Т. реален газ, когато температурата спадне, и б) отрицателен ефект. когато (идеален газ Т = конст). От практически интерес е положителен ефект. Положителният ефект се наблюдава при silyprityazheniya на налягането доминиран
между молекули. Когато разширяват газови молекули действат срещу силите на привличане и температурата се понижава. Кинетичната енергия на топлинното движение на консумирана в операцията срещу силите на молекулното привличане газ.
Промяната на температурата може да бъде значителна. Например, въздухът се разширява при стайна температура, налягане от 200 атм до 1 атмосфера налягане се охлажда до приблизително 40.
Методът се използва в областта за втечняване на газове. От ефекта на Джаул - Томсън работа се основава т.нар Linde машини.
Втечняване на газ и ниска температура се получи
Газът може да бъде превърнато в течно състояние, когато температурата е под критичната температура и под точката на кипене при дадено налягане.
Linda машина (немски учен) (фиг. 9.5)
Атмосферния въздух е компресиран от компресор (К) до налягане от 220 атм. Сгъстен въздух преминава през тръбопровод течаща вода и се охлажда до 10, 15. На следващо място, въздухът навлиза във вътрешния канал
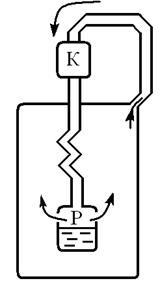
намотка от резервоара (R), при налягане 20 атм. Когато този въздух се охлажда до 50 (разширителен среща в положителния ефект на Джаул - Thomson) .. Охладеният въздух на канал на външната намотка определя на компресора, охлаждане тези части на въздуха, като достига вътрешния канал и т.н. При температура 180 и налягане 20 атм. Air конденз започва. Течен въздух се влива в резервоара.
Разширяване турбина Капица (български учен и носител на Нобелова награда, 1894-1984). Газ компресиран от компресора (С) до налягане от 6-7 атм се подава към турбината (Т), се разширява до налягане 1,3 атм. извършва работа, охлажда допълнително охлажда газа въвеждане на компресора се разпространява и т.н. и най-накрая се кондензира. Този метод може да получи течен азот, кислород, водород, хелий. (Забележете, че точката на кипене течен кислород 90 К 78 К от азот, водород, 20К, 4.2K хелий). Течни газове, използвани в промишлеността, медицината и авиацията.
Свързани статии
