целулозни нитрати (SC) са енергийни и структурна основа nitrattsellyuloznyh прахове и твърди горива.
целулозен нитрат наречен целулозни естери и азотна киселина. За производството на целулозен нитрат целулоза използва се съдържа в памук, дърво, лен, слама и др. П. в количество от 92-93% (памук) и 50-60% (дървен материал). За да се произвеждат висококачествени чист нитроцелулоза използва целулоза, получена от споменатата суровина специална химическа обработка.
целулоза молекула се състои от голям брой идентично конструирани и взаимосвързани S6N10O5 глюкозни остатъци.
Следователно, общата формула е целулоза (S6N10O5) п, където п - броят на глюкозните остатъци.
Всяка глюкозен остатък има три хидроксилни групи ОН. Именно тези хидроксилни групи реагират с азотна киселина, съгласно схемата:
,
където m = 1; 2 или 3.
В зависимост от условията на нитриране може да бъде заменен, не всички хидроксилни групи, но само някои от тях. Поради тази причина се оказва, не една, а няколко различни степени на естерификация на нитроцелулоза.
целулоза структура не може да изрази определена формула дължи на факта, че той не е еднакъв в молекули размер. Още по-голяма степен се отнася до целулозен нитрат, които също са съставени от молекули, неравномерно степен на естерификация. целулозни нитрати в зависимост от съдържанието на азот (степен на естерификация), разтворимост във spirtoefirnoy смес и степента на полимеризация е почти класифицирани в следните видове: пироксилин № 1, пироксилин № 2 смесен пироксилин маркировките BA, СА, NA, pirokollody и колодий различни марки Н, ВНВ, PSV, KP
13.Marki пироксилин използва в претенции за производство. Защо не един и същи тип, използван в производството на пироксилин, колодиум. Обяснете.
целулоза структура не може да изрази определена формула дължи на факта, че той не е еднакъв в молекули размер. Още по-голяма степен се отнася до целулозен нитрат, които също са съставени от молекули, неравномерно степен на естерификация. целулозни нитрати в зависимост от съдържанието на азот (степен на естерификация), разтворимост във spirtoefirnoy смес и степента на полимеризация е почти класифицирани в следните видове: пироксилин № 1, пироксилин № 2 смесен пироксилин маркировките BA, СА, NA, pirokollody и колодий различни марки Н, ВНВ, PSV, KP.
пироксилин № 2 изцяло набъбва в spirtoefirnoy смес и частично определя течния разтвор. Пироксилин № 1 само частично набъбва в разтворител, но е между солватирани частици пироксилин № 2 става подвижна, т. Е. Guncotton № 1 и 2 guncotton № взаимодейства не само с разтворителя, но също така един с друг. Установено е, че разтваря guncotton № 2 е по-ефективен пластификатор за пироксилин № 1 от spirtoefirnaya смес.
Чрез разтворим се означава количество SC който е преминал в разтвор в проба обработка (1 г) spirtoefirnoy смес (150 мл)
със съотношение от 1: 2 (по обем).
Намалена разтворимост поради намалението smesevogo пироксилин, съдържаща пироксилин № 2 води до намаляване на използването на разтворител. Въпреки това, при много ниско съдържание на пироксилин № 2 на потреблението смес от разтворители също се увеличава. Това се дължи на факта, че лошо guncotton № 1 spirtoefirnoy пластична смес, така че е необходимо да се увеличи активността spirtoefirnoy смес чрез увеличаване на съдържанието в него на етер.
Чрез кафяви, най-добрата пластичност при същата скорост на потока разтворител трябва sredneazotnye разтворимост пироксилин от около 40%.
Основната роля в подуване смесен пироксилин играе guncotton № 2. Един от основните параметри, определящи поведението на пироксилин № 2 е степента на нитриране.
Пластификаторите целулозен нитрат. Ако целулозни нитрати са способни уплътнен до плътност от 1600-1670 кг / м3 (1,60-1,67 г / cm3) и формовани под натиск разглежданата, прахът може да бъде направен от единичен компонент - нитратите на целулозата. Все пак, това е невъзможно. Това се дължи на липсата на целулозен нитрат свойства на пластичност.
Те са твърди вещества влакнеста структура, ронлива, с голям брой на макро - и микро кухини, изпълнени с въздух, и се състои от твърд полярни макромолекули, свързани заедно, а здраво различни сили (Interpacket и междумолекулно) и не е способен оглед на изместване един спрямо друг. Те нямат термопластичност дори при високи температури и са в стъкловидното състояние.
Общото свързване енергия между макромолекули по цялата им дължина, може значително да надвишава енергията на свързване между отделните вериги връзки. Следователно, за да откъсне една молекула от друг толкова силно, колкото да се прекъсне макромолекули в отделни единици.
Общият размер на енергия на междумолекулните нетрофините на взаимодействие далеч надхвърля размера на топлинната енергия на движение на веригата връзки и сегменти макромолекули. При нагряване, NC унищожаване на химически връзки възниква преди общото отслабване на вторичната (и Interpacket междумолекулните) връзки ще бъдат достатъчни за осигуряване на условия за прехода от стъкловидно вещество в много еластична и вискозно състояние.
Установено е, че нито натиск, нито температура, нито времето на престой в корнизи преси SC не може да доведе до тяхното пластично състояние. Ето защо, за да се даде NC такива свойства, които определят потока му под влиянието на външни сили, деформиращи се, те трябва да бъдат променени.
Един метод е пластифициране на модификация НТС. Тя се състои от въвеждане на полимера в различни течности и твърди вещества (пластификатори), за да се улесни обработката му и за подобряване на еластичността на материала и разпространява мразоустойчивост.
Когато пластична вискозитет на системата на климата увеличава гъвкавостта и мобилността на макромолекулите дупрамолекулните структури. За колодий, pirokollodiya, пироксилин № 2 смесен пироксилин добро пластификатор е смес от етилов алкохол с диетилов етер. Имайте предвид, че индивидуално етилов алкохол и диетилов етер не са пластификатори НК.
Най-ефективният пластификатор на SC (от колодий да пироксилин) с най-висока степен на естерификация са ацетон и етил ацетат. Нитроглицерин nitrodiglikol са добри пластификатори колодиум. Допълнителни пластификатори са динитротолуол, дибутил фталат.
При добавяне към пироксилин подходящо количество spirtoefirnoy смес, получена маса, която лесно се деформира от външни сили, но след натоварването се отстранява до първоначалното състояние не се връща, т. Е. В системата има голяма остатъчна деформация поради пластмаса поток, който е известен винаги усложнява от развитието на каучуково деформация.
15) Най-важното е прост, диетилов етер. чиято формула е както следва: (С2Н5) 2О или S4N10O. Той е безцветен, прозрачен и много мобилни летлива течност с особен остра миризма и вкус. Под влиянието на светлина, въздух, топлина и влага може да влоши етер, като се образува токсични алдехиди и кетони пероксиди, които дразнят дихателните пътища. При температура на водата от 20 градуса се разтваря с 6,5%. В него се смесват добре с мазнини и етерични масла, бензин, и алкохол, независимо от съотношението. се етер, обаче, тъй като неговите пари, запалим. В някои част с кислород или въздух двойка етер използва за анестезия, ВВ
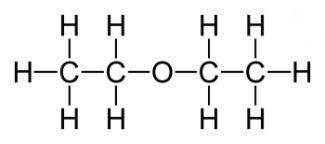
За химични свойства диетилов етер се характеризира с всички свойства етери химически. Така че нека да се справят с този проблем в подробности. Това е доста инертно вещество. Основната разлика от естери - липсата на хидролиза, обаче, има и изключения. В студени условия не реагира с фосфорен хлорид, натриев метал и много разредени минерални киселини. Въпреки това, силни киселини (сярна и метафосфат) дори при ниски температури, тези естери се разлагат и се нагрява от метален натрий ги отцепва. Естер с самотен двойки електрони взаимодейства с протона на силна киселина, при което се образува нестабилна оксониева съединение: - ацидолиза. Сярна киселина и йодоводородна киселина и FeCl3 в оцетен анхидрид способна да разцепва етери. Химическата реакция е както следва: СН3-СН2-О-СН2-СН3 + HJ → СН3-СН2-ОН + J-СН2-СН3. - Реакцията на металиране, наречен Shorygina реакция. отопляеми метален натрий разцепва диетилов етер: С2Н5-О-С2Н5 + 2Na → C2H5ONa + C2H5Na - относителна химическа инертност не пречи естери по време на съхранение на въздух, за да образуват пероксиди, което често води до експлозии в края на дестилацията.
Диетил етер: физични свойства особен мирис, ниски етери точка на кипене - доказателства за слабо междумолекулна въздействие, и това показва ниска полярност и отсъствие предпоставки за образуване на водородни връзки. За разлика от естери на алкохоли, присъщи силни електрон-донорни свойства, както е видно от стойността на потенциала на йонизация. Амплификация на тези функции е свързан с положителен индуктивен ефект групи от атоми, в резултат от алкан чрез отстраняване на водороден атом.
Точката на кипене на диетилов етер - 35,6 градуса по Целзий (това е много по-ниска от тази на изомерни алкохоли) и замразяване - 117 ° С Етери едва ли се смесва с вода. Обяснението за това е много прост: те не са способни да образуват водородни връзки, тъй като техните молекули имат полярни връзки. Слабо разтворим във вода и диетилов етер, плътността на който по отношение на водород оксид е 0.714. Една от характеристиките на въпросното вещество, което се наблюдава тенденция за electrization. Вероятността за поява на статично електричество е особено висок при изпразване или презареждане на химичния състав, при което може да се случи запалване. естерна форма двойки с въздуха, който е 2,5 пъти по-леки експлозивни смеси. Долна граница на експлозия - 1,7%, а горната - 49%. Работа с етер, ние не трябва да забравяме, че двойките са склонни да се разпространяват на големи разстояния, без да губи способността да горят. Така че основната предпазна мярка - липсата на до пламъци или други източници на запалване. Етер - неактивно съединение в пъти по-малко реактивни в сравнение с алкохоли. Забележително е, че той разтваря най на органичната материя, при което се използва като разтворител. Изключение е не и диетилов етер. Физични свойства, както и химически, позволяват използването му в медицината и в промишлеността
Получаване на диетилов етер Етери не се срещат в природата - се получават синтетично. Под влияние на киселинни катализатори етилов алкохол при повишена температура, се получава диетил етер (горната формула). Най-лесният начин за получаване на това вещество чрез дестилация, смес, състояща се от сярна киселина и алкохол. За да направите това, трябва да се нагрява до температура 140-150 градуса по Целзий. Трябва етилов алкохол и сярна киселина (в равни пропорции), пипети, епруветки и отдушник тръба. Така че, след като оборудването и реагентите са готови, можете да започнете да изпитат поведение. Тръбата (който задължително трябва да бъде суха) трябва да се излива 2-3 мл смес от алкохол и киселина и се загрява бавно. Веднага след като кипене, горелката се отстранява и горещата смес се накапват по стената на тръбите се добавя от 5 до 10 капки от етанол. Изтичащите реакция е както следва: СН3-СН2-ОН (етилсярна киселина) + H2S04 СН3-СН2-OSO3H + Н 2О; СН3-СН2-OSO3H + CH3-О-СН3; СН3-СН2-О-СН2-СН3 (етер) + H2SO4. Върху формирането на диетилов етер показва имаше миризма.
състав и формула етанол, а именно - звучи така един официалното си име - се отнася до прости алкохоли. Той знае почти всичко под един или други имена. то често се нарича просто алкохол, понякога се добавя към прилагателни "етиловия" или "вино", химици също могат да го наричат metilkarbinolom. Но същността е една и съща - C2H5OH.
Физични и химични свойства на етанол са присъщи общи характеристики и всички реакции на алкохоли. Той е безцветен, има характерен мирис и вкус. При нормални условия е течност, влиза в твърда форма при температура от -114 ° С и се кипи при 78 градуса. Плътност на етилов алкохол е 0.79. Тя се смесва добре с вода, глицерол, бензен и много други вещества. Лесно е да се изпари, така че трябва да се съхраняват в добре затварящи контейнери. Сама по себе си е отличен разтворител и също така има отлична антисептични свойства. Лесно запалим както в течност и в състояние на пара. Етанолът е психоактивно вещество и наркотично, част от всички алкохолни напитки. Летална доза за възрастен е 300-400 мл 96% разтвор на алкохол, които се заемат продължение на един час. Тази цифра е доста произволно, тъй като това зависи от много фактори. За деца, които вече са достатъчно 6-30 милилитра. Така че етанолът също е много ефективна отрова. Въпреки това, той е широко използван, тъй като има редица уникални свойства, които го правят универсален
Получаване на диетилов етер Етери не се срещат в природата - се получават синтетично. Под влияние на киселинни катализатори етилов алкохол при повишена температура, се получава диетил етер (горната формула). Най-лесният начин за получаване на това вещество чрез дестилация, смес, състояща се от сярна киселина и алкохол. За да направите това, трябва да се нагрява до температура 140-150 градуса по Целзий. Трябва етилов алкохол и сярна киселина (в равни пропорции), пипети, епруветки и отдушник тръба. Така че, след като оборудването и реагентите са готови, можете да започнете да изпитат поведение. Тръбата (който задължително трябва да бъде суха) трябва да се излива 2-3 мл смес от алкохол и киселина и се загрява бавно. Веднага след като кипене, горелката се отстранява и горещата смес се накапват по стената на тръбите се добавя от 5 до 10 капки от етанол. Изтичащите реакция е както следва: СН3-СН2-ОН (етилсярна киселина) + H2S04 СН3-СН2-OSO3H + Н 2О; СН3-СН2-OSO3H + CH3-О-СН3; СН3-СН2-О-СН2-СН3 (етер) + H2SO4.
Свързани статии
