скорост многостепенен процес в системата на мултиен. Това зависи от концентрацията на междинни продукти, както и конц. подходящ ензим и ко-фактор. Скоростта на всеки етап се определя от фиксиран край и на междинния продукт и концентрацията на съответния ензим. Стационарни конц. Всички междинни съединения и кофактори определят съотношение на скоростта на тяхното образуване и консумация зависи не само от активността на някои ензимни системи, но също и от други ензимни скоростите р-ции, в които се използват тези съединения.
Ензимната активност в тялото, и плоча-на скорост, но ензимна р-ТА влияе от редица фактори: афинитета на субстрата, постоянната Mihaelesa. температура, рН, конц. субстрат и дек кофактори. необходимо за действието на ензими, присъствието на активатори и инхибитори.
Специална роля в регулирането на активността на ензими играят коензим.
В случай на отсъствие в организъм достатъчно количество коензими и кофактори, ензимна активност намалява.
Ензимната активност зависи от конц. субстрат. участва в ензимна р-ТА. При стационарно състояние на субстрата р-нето снабден с една и съща скорост, както се използва в р-нето. Увеличаване конц-ЛИЗАЦИЯ предизвиква ускоряване на субстрат р-нето на нов стабилно състояние, където новата скорост р-нето съответства на нов краен нето на субстрата.
Известна система polyenzyme. в която процент р-ции ензимна се контролира концентрацията на крайния продукт във веригата на последователни преобразувания. В основата на този вид регулиране е инхибиране (или активиране) 1 етапи ензим ING в крайните биосинтеза продукти, наречени инхибиране р-ТА (или активиране) на типа на обратна връзка. Инхибитори и активатори, действащи на принципа на обратна връзка, наречени ефектори.
20 класификация на ензимни реакции в ред. Chem р-ТА, в proish биологични системи са разделени Molecular и обща процедура. Mol-ва обективирано Xia брой частици, които участват в химически трансформации. Реакциите в елементарни действия, свързани с 1, 2 или 3 частици се наричат моно-, би- и тримолекулен р-ции. Вероятността за колизия на повече от 3 малки частици и р-ТА случи няколко елементарни стъпки. За биологични системи и са характерни за моно-ШИРОК bimol р-ТА. Важна характеристика на скорост на реакцията Coy yavl. Скоростта на химически процес - това увеличение или намаление на време с веществото. Броят на сблъсъци за дадени външни условия е р-му в концентрация от взаимодействие-ин. Условия на околната среда - температура, налягане, сряда. В резултат, р-ТА част на изходните молекули използвани в образуването на продукти на р-ТА и в С-лит намаляваща, скоростта на р-ТА намалява. Това е причината, че моно- и бимолекулярен са р-ТА с непрекъснато намаляващ скоростта.
Ако скоростта на р-ТА независимо от реагентите С, след това се нарича реакция на нулев порядък. Да предположим, че А-в се превръща в количество със скорост, която е независима от вещество А. Пример С може да бъде ензимно р-ТА простираща се в условия на излишък субстрат. Кинетичната уравнението на процеса има следния вид:
Разтворът на това уравнение е линейна функция на времето:
б = k0 т + С2. където C - константа на интеграция
-Към Т, като намалява концентрацията
Ko т, защото увеличава концентрацията
Към тези уравнения могат да бъдат приложени на практика трябва да се намери на гранични условия C при т = 0, А = a0, б = 0.
Реакционната първи ред - процес, който зависи от скоростта на една от концентрации (от едно от веществата, С). Да предположим, че вещество А се превръща в съединение V с R1 скорост.
Решението на този Ур-ТА yavl. Изтича:
Условие започва при т = 0, А = a0, Ь = 0, = С1 a0. С по островите в резултат закона за запазване на материята и + б = a0, б = a0-а. Graficheskiski р-ТА, както следва:
P-ЛИЗАЦИЯ втори ред - процес, който зависи от степента на концентрация на реагирането-В. Нека острови А и Б да се даде в C със скорост К2. Чрез х означават броя на всеки в-ва, консумирана при време Т. За всеки от тези а-х ще бъде в същото (като взаимодействието на островите в отношение 1: 1) те образуват .Kin Ур: DX \ DT = k2 (А0 - х) (b0 - х) В първо-G на 2-ри реагиращите р-ТА п-ка е изтекла от порядъка на първата схема р-ТА, ненужно. C, например, на островите ще бъдат редактирани в Ся.
Отличителна черта на кинетиката на биологични процеси е наличието в системата на средства, способни да повлияе на скоростта на р-ции. Това са ензими, които катализират биохимични. трансформация. Ензимната кинетика изучава закономерностите на влиянието на химическата природа на реагентите, и пералня. тяхното взаимодействие върху скоростта р-ции. Скоростта на химичното вещество. Р. влияе от следните фактори:
-Т 0. V увеличава р-ции процент с повишаване на температурата до определена граница.
-t.k.fermenty включва ко-ензими, и метали, степента на концентрация r.zavisit коензими, и метали.
-в присъствието на р-ре декември инхибитори на активатор и ензим.
Скоростта на р-ции, предмет на закона, според който се извършва реакцията, по-бързо от по-големия край. в-ин. Да предположим, че има р-ТА A + C + D
v1 е пропорционално на произведението от концентрации на А и Б. v1 и концентрацията на С е постоянна скорост D.k1. Това нормализирана скорост, т.е. р е равна на скоростта нето при концентрация на реагентите = 1.
Ако има химически равновесие. т.е. v1 = v1 можем да запишем:
keq е постоянна -он баланс е продукт на концентрация iskh.v-в в равновесие.
В началото на 20-те v.bylo е установил, че ако концентрацията на F поддържана. t-конст, и първоначална концентрация на субстрата варира в широки граници. началната скорост на промяна г е прав-ТА с насищане:
Тази крива показва. Зависимостта е близо до линейна на първо (при ниски концентрации на субстрат), и след това достига максималната стойност. р-ТА от първи ред при ниски концентрации на субстрат трансформирани в нулев порядък р-нето (скорост t.e.pri която р-ТА е независим от конц. реагира до з), скоростта на р-ТА е пропорционална на концентрацията на ензима. Мат. модел F-ти катализа е разработен и Mihaelesom menthenyl през 1913. те предложи двустепенна последователност от процеси:
E + S ES + E P. където Р е продукт, S-субстрат ензим Е.
в един първи етап, който е обратим ензим-субстрат комплекс, който след това се разлага необратимо към крайния продукт F и изпускания молекулата да участват в следващия цикъл. Кинетичните променящите се концентрации на реагенти са от вида: DS \ DT = -k2 ES + к -1 (ES)
DP \ DT = k1 (ES) = - DS \ DT
за решаване на система от уравнения. налагане на допълнително условие за затворената sistemu.Obschee брой ите. р sopst остава в реакционната смес. Общ брой молекули от F е константа.
С помощта на тези данни, пишем с-та уравнения, както следва:
налагат гранични условия: т = 0, т (ES)
Това означава, че кинетичната крива ж.к.. (Ове) ще съдържа най-много. Производното на макс. де \ DT = 0 - процес състояние стационарност E + S Es Е + P
разтвор на най-дез \ DT = 0 ни дава:
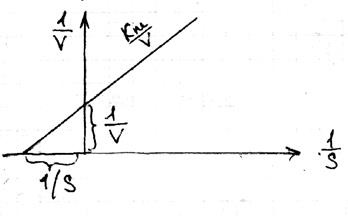
23 уравнение Laynuvera Berka
Чрез fiz.smyslu измерение и Km е концентрацията на субстрат. при което половината от молекулата на субстрата, при която половината от молекулите на ензима в състояние комплекс. Стационарност на ензимната процес протича където конкуренцията е по-голяма конкуренция ензимен субстрат, т.е. има непрекъснат поток и изтичане на субстрата продукти. За скорост р-ТА
При много високи концентрации на S, Vstremitsya Vmax S \ (к м + S)
Laynuver и Бърк предложи да се премине към линейна форма. които показват обратна връзка: 1 \ V = 1 \ Vmax (км \ S 1) - уравнение Laynuver Berka.
Това в-ТА е най-удобно да се провери:
Отличителна черта на кинетиката на биологични процеси е наличието в системата на средства, способни да повлияе на скоростта на р-ции. Това са ензими, които катализират биохимични. трансформация. Ензимната кинетика изучава закономерностите на влиянието на химическата природа на реагентите, и пералня. тяхното взаимодействие върху скоростта р-ции. Скоростта на химичното вещество. Р. влияе от следните фактори:
-Т 0. V увеличава р-ции процент с повишаване на температурата до определена граница.
-t.k.fermenty включва ко-ензими, и метали, степента на концентрация r.zavisit коензими, и метали.
-в присъствието на р-ре декември инхибитори на активатор и ензим.
Скоростта на р-ции, предмет на закона, според който се извършва реакцията, по-бързо от по-големия край. в-ин. Да предположим, че има р-ТА A + C + D
v1 е пропорционално на произведението от концентрации на А и Б. v1 и концентрацията на С е постоянна скорост D.k1. Това нормализирана скорост, т.е. р е равна на скоростта нето при концентрация на реагентите = 1.
Ако има химически равновесие. т.е. v1 = v1 можем да запишем:
keq е постоянна -он баланс е продукт на концентрация iskh.v-в в равновесие.
25 стабилно състояние, както и класификацията на мултиен системи.
Целият цикъл обмен е една отворена система, в кат. През цялото време, получени през островите от външната среда. Те се подложи на трансформация в тялото и се отстранява във формата на крайни продукти. Регулирането на биохимични процеси в клетката с помощта на правата и обратната връзки. Назначаване на регулирането е да се поддържа концентрация в azlichnyh-в в клетката в нивото. котка. Тя се определя от нуждите на клетката. Повечето биохимични реакции, катализирани от ензими, така регулиране механизъм е да се промени ензимната активност и концентрация. Polyfermental е система от свързани ензими, които катализират различни етапи на метаболитните процеси. Ако polyfermental концентрации с-ми на всички компоненти. а именно ензим субстрат и продукт р-нето, с конст остане във времето. е-ma момента в стабилно състояние. За разлика от стационарни равновесие състояние от това в държавния стационарен ч \ о н-ти поддържа постоянно стационарен поток в островите и държавен х-Ся Конст енергийния поток. В състава му polyenzyme системи могат да бъдат хетерогенни хомо. Най-важният процес в polyenzyme C-MAX могат да бъдат класифицирани в следните типове:
може да се открои с саморегулираща ma (с-ни с обратна връзка)
26svobodno радикални процеси в биологичните системи
в биологични процеси всички видове синтетични пластмасови IE на енергия, носени от дискретни, в който играе важна роля един електронен трансфер на енергия и образуването на парамагнитни частици с едно или д-ми несдвоени (свободни радикали). Свободните радикали са с висока активност. Между броя на несвоени електронна концепция е нова и свободна валенция на атома е директен идентичност. Островите с несдвоен-д Е в разделени от 2:
-в -wa в която несдвоени електрони са свързани или към цялата мол ekuloy или с по-голямата си част. Това несдвоен д-HN премества заедно силно делокализирани молекулни орбитали висока активност и да причини външните групи от атоми.
-на островите в която несдвоен д-HN свързва с молекула с един атом. Те не се движат по молекулни орбитали, които са обхванати всички атоми. Такива несдвоени E-нй връзки. преход група от атоми (Fe, Co, Ni) / несдвоени електрони са от интерес за изследване на механизмите на полупроводници.
Той е този, който определя
-монорадикал един несдвоен E-класиран (ОН -)
-двувалентни радикали с 2 несдвоен Е-Е.
Свързани статии
