Молекулите се състоят от еднакви или различни атоми, свързани в един свързващи сили, които се наричат с химически връзки. Силите, които притежават атомите в молекулата, причинени от взаимодействието на външните електрони.
Има два вида комуникация. Един от тях се извършва в тези молекули, в които част от външните електрони, които се движат около двете ядра (самите ние само двуатомни молекули лимит). Такава връзка се нарича ковалентна или ковалентна връзка. Чрез свързване с такива молекули включват молекули с идентичен ядра (Н2. N2. О2) и молекули с различни ядра (например, CN).
Вторият тип на свързване възниква в случая, когато електрони в молекулата могат да бъдат разделени в две групи, всяка от които в момента се намират в един от ядрата. Електроните са разпределени така, че едно от ядрата около излишък на електрони, а за друг - техният недостатък. По този начин, на молекулата, тъй като се състои от две йони на противоположни знаци, привлечени един към друг. Този вид комуникация се нарича heteropolar или йонни. Пример на йонни molekuls връзка може да служи NaCl, KBr, солна киселина и така нататък. D.
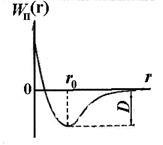
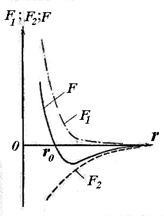
Независимо от естеството на силите, които водят до образуването на стабилна система от два атома може да направи някои общи наблюдения върху природата на тези сили. Атомите намират на значително разстояние един от друг, не взаимодействат с други дъги. Чрез намаляване на разстоянието между R атомните ядра увеличава взаимното привличане сила действа между атомите (вж. Фиг. 11.5, F2). Въпреки това, тези сили не са единствените. На малки разстояния между атомите оказват въздействие си от силите на взаимното отблъскване F1. Не позволявайте на електроните на един атом е твърде дълбоко проникват в електронен слой на другата атом. една отблъскваща сила е с малък обхват, отколкото на силата на гравитацията. Поради едновременното действие на разлика насочени сили - привличане и отблъскване - при r0 разстояние между атомите на баланса на две сили помежду си и техните геометрични размер (получената сила F) е нула.
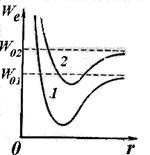
По принцип променят молекули за съхранение на енергия се случи, както в атом, в резултат на промени в електронен конфигурация, образувайки периферна част на молекулата. При смяна на електронен конфигурация (при възбуждане молекула) измествания кривата на електронна енергия от разстоянието между ядрата (вж. Кривите 1 и 2 на фиг. 11.7). За дадена електронна конфигурация атома молекули могат да претърпят вибриращо движение един спрямо друг и върти на общ център на масата. Общата енергия на неподвижно състояние на молекулата може да се представи като:
където Ние - енергия поради конфигурацията на електрон, Wv - енергия вибрационно движение, Wr - енергията на въртеливо движение.
С помощта на уравненията на квантовата механика, може да се докаже, че не само при смяна на електронна конфигурация, но с различна енергия вибрационно и ротационно движение, енергията на споменатите типове движение има дискретни стойности и могат да бъдат изразени, както следва:
о = 0, 1, 2, 3, ...; # 969 об - цикличен честота на трептене; J - на въртене квантовата номер, който може да се следните стойности: J = 0, 1, 2, 3, ...; I - инерционен момент на молекула спрямо оста, минаваща през центъра на маса.
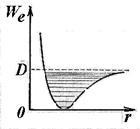
Уравнение (11.5) определя енергията на хармоничен генератор. Както колебанията на енергия (увеличаване на квантово число о) anharmonicity наблюдава, което води до сближаване на нивата на вибрационното движение, което има за ограничение дисоциация енергия на молекулата (Фиг. 11.8).
Така, съгласно (11.5) и (11.6) polnayaenergiya молекула е:
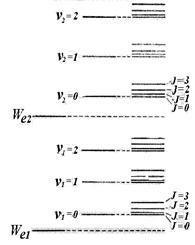
Опитът и теория показва, че разстоянието между ротационните нива # 8710; Wr значително по-малко от разстоянието между вибрационни нива # 8710; Wv. което от своя страна е много по-малко от разстоянието между нивата на електрони # 8710; Ние. По този начин, схемата за енергийно ниво на молекула изглежда, както е показано в ris.11.9 (показани само две електронен ниво). Набор от нивата се съдържа в дясната колона на фигурата. В първите две колони обясняват само възникването на нива.
Молекулярна спектри са доста различни от ядрената енергия. Атомна спектри се състои от отделни линии,
молекулните спектрите се състоят от ленти, едната с остри ръбове и замъглено от друг. В изследване на тези спектри с помощта на устройства с висока разделителна способност се определя най-важните физическите характеристики на молекулите: дължината на връзка, енергията връзка, моментът на инерция.
Свързани статии
