Алкални метали. Оксиди, пероксиди, хидроксиди и соли на алкални метали
12.1. Общи характеристики на алкалните метали
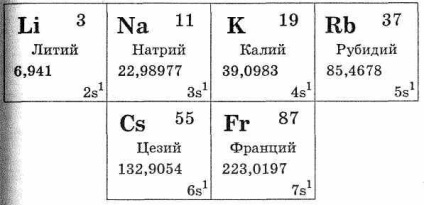
В групата на алкалните метали включва набор от следните елементи: литиев Li, Na натриев, калиев, К, рубидий, Rb, Cs цезий, Франций Fr. Те са в основната подгрупа на група I Coy периодична система. Всички тези метали са подобни в смисъл, че външната им електрони слой има един електрон (вж. Таблица. 28). Алкални метали са сред S-елементи. Електронни външен електронен алкален метален атом слой в сравнение-niju с други елементи на същия период, отстранени от сърцевината, т.е. радиусът на металния атом на алкален, в сравнение с най-голям радиус на атомите на елементите на същия период. В тази връзка, всички валентен електрон външен слой от алкални метални атоми лесно да влезе, ги прави еднократно зарежда положителни йони. Това се дължи на факта, че съединения на алкални метали с други елементи са изградени в зависимост от вида на йонна връзка.
В редокс реакции IU алкална талий се държат като силни редуциращи средства, и тази способност се увеличава от метално зареждане с увеличаване на атомното ядро.
Физични и химични свойства на елементи от група I основна група
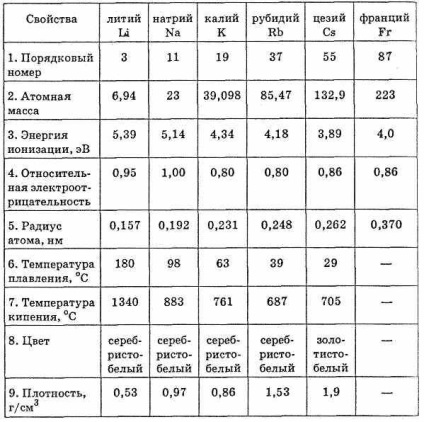
Сред алкалните метали проявяват най-ви sokuyu реактивност. В серия от стрес Най всички алкални метали са поставени в началото на серията. Електронни външен електронен ниво е само един валентност електрон-трон, така алкални метали в съединения с всяка валентност. Степента на окисление на алкален метал е обикновено 1.
Алкални метали лесно се окислява във въздуха, водата и киселини. За да се предотврати окисление, се съхраняват в затворени (обезвъздушава) потопена съдове или етер, керосин и т.н. Окислението на алкални метали, в атмосфера на кислород протича много енергично и се формира с тип R2 O2 метален пероксид. Оксиди могат да се получат само при определени условия.
Алкални метални оксиди R2 O притежават ясно изразени основни свойства активно реагират с вода, киселина-E и кисели окиси.
В реакцията на алкални метали или техни оксиди, образувани от вода, хидроксиди на алкални метали, - алкален ROH - са силни основи, основни свойства количка-стопят с увеличаване атомен номер. Намаляване свойства на алкални метали, изразени толкова много, че нагряване тях в атмосфера на водород хидриди са оформени, в които степента на окисление на водород е равна на 1. Водородни алкални съединения отговарят на формула RH. Това бяло кристално вещество.
^ 12.2. Получаване и химични свойства на метали натрий и калий пример алкален
Да бъдеш в природата
натриев и калиев Получаване
Натриев хлорид произведени чрез електролиза или натриев хидроксид. В електролиза на NaCl разтопен натриев на катода се освобождава:
Na д - Na ° и анода - хлор: 2Cl - 2 е - Cl 0 2
В електролиза на стопен NaOH натриев на катода се освобождава, и анода - вода и кислород:
Поради високата цена на основен метод модерен Nym натриев хидроксид за получаване на натрий е електролизата на стопен NaCl.
Калиев могат да бъдат получени чрез електролиза на стопен КС1 и КОН. Въпреки това, този метод за получаване на калиев намери roubleshooting-разпространение поради технически проблеми (ниска мощност ток, трудността на осигуряване на безопасността). Текущ мислене за получаване на калиев-основава на следните реакции: KCl Na = NaCl К (1)
В метода (1) през стопения калиев хлорид преминава натриев пара при 800 ° С и се развили пари кондензира калиев ruyut. В метод (2) взаимодействието между стопения калиев хидроксид и натриев течност-ком protivoto извършва при 440 ° С в реакционната колона на никел.
Натрий и калий - сребро-бял метал, много мека, лесно да се реже с нож.
Естествен натриев състои от един изотоп 23 ноември натриев, калиев - от две стабилни изотопи 39 19 К (93,26%) и 41 19 К (6.73%) и един радиоактивен 40 19 К (0,01%). Проучванията използва радиоактивни изотопи произведени синтетично 22 ноември Na,
натриеви и калиеви атоми на химическо взаимодействие до получаване определят-валентност електрони, преминаващи в положително заредени йони конюгиран: Na и К. двете метали - силни редуциращи агенти.
Ако натрий и калий в малко количество окисляващ коте loroda при температура от около 180 ° С, се получават оксиди:
Поради лесно и бързо окисляване на натрия и калия те се съхраняват под слой от парафин или восък, където восък предварително зачитат, защото керосин все още се разтваря някои Coli почести въздух и окисляване, макар и бавно, все още продължава.
Натриев и калиев може да се получат съединения с водород - указания-Rida, в която водороден проявява брой окисляване -1. Тази сол, като съединение, което от естеството на стойността на химична връзка и окисление се различава от летливи водо-
естествени съединения на елементи от основните подгрупи IV - VII групи. Метални хидриди разлагат лесно с вода за образуване на сажди лзвани алкален и водород:
Натриев и калиев може да взаимодейства не само с кислород и водород, но също с много прости и сложни вещества: 2Na S = Na2 S 2K Cl 2 = 2KSl
Натриев и калиев реагира не само прост, но и сложност-TION с вещества, например вода, измествайки водород тях:
Калиев реагира по-бързо от натриев: 2K 2Н2 О = H2 2KOH
Запалена алкален метал не може да се погасява с вода. Неговата изсипва минерално масло или смес от талк е изпълнен с NaCl. Безцветен факел пламък е оцветен в жълто натриев и калиев - в лилаво.
Натриевите и калиевите сплави се използват като топлоносители в ядрени реактори. Натриев изпарения газ напълнена газоразрядни лампи. Натриев - редуциращ агент в металургията (в, производство Ti, Zr, Ta), се използва като катализатор в органичния синтез и други области ..
Калият се използва в областта на електротехниката, да бъде отговорно лице | хранителен компонент растение.
^ 12.3. Оксиди, пероксиди, хидроксиди и соли на алкални метали, например натрий и калий
Те нямат особено значение натриеви и калиеви оксиди. Те реагират енергично с вода до образуване на натриев хидроксид и калиев хидроксид, съответно:
Те проявяват всички свойства на основните оксиди.
Натриев пероксид Na2 O2 - жълтеникав прах. Това може да се разглежда като вид на сол на водороден пероксид, защото неговата структура е същата като тази на Н 2О 2. Като водороден пероксид, perok-
натриев LED е най-силният окислител. Когато се разтваря във вода, образува алкален водороден пероксид и кислород:
Водороден пероксид, образувана по време на действието на разредени киселини с натриев пероксид:
С въглероден диоксид на въздуха натриев пероксид реагира съгласно уравнение:
Поради това се използва в дихателен апарат за Rege-neratsii въздух - поглъщане на въглероден оксид (IV) и отделяне на кислород.
натриев пероксид, освен това, се използва за избелване на тъкани, кости, коса и др ..
Много важни съединения са натриев хидроксид, или натриев хидроксид, натриев хидроксид, се нарича също сода каустик или сода каустик и калиев хидроксид, или калиев хидроксид КОН. Те се наричат също алкална основа, защото Те са лесно разтворими във вода.
Калиев хидроксид и натриев хидроксид - непрозрачни бели кристални твърди вещества. водоразтворим vyde leniem на с голямо количество топлина.
В водни разтвори практически напълно отделени и силни основи са:
NaOHNa ОН - KONK ОН -
Exhibit всички свойства на базите.
Твърди натриеви и калиеви хидроксиди и техните водни разтвори абсорбират въглероден оксид (IV):
В твърдо състояние във въздуха NaOH и КОН абсорбира влагата, така че те се използват като сушене газове.
В промишлеността, натриев хидроксид и калиев хидроксид в концентрирани разтвори Luciano електролиза NaCl и КС1. В същото време хлор и водород се получава. SLU катодно-INH мрежа, анод - графит.
Калиев в редица стандартни електродни потенциали Raspaud фалшиви до алуминиеви йони са намалени и много труд-й от водните молекули. H йони в разтвор е много малък. Следователно катода изпълнява само водни молекули да освободи п-молекулен водород. Хлоридни йони в концентрирана Ras създава лесно дари електрони (окисляване) от водните молекули, така че освобождаването на хлорни йони в анода.
Общото уравнение на електролиза в йонна форма:
Подобно електролиза протича разтвор на натриев хлорид. Разтвор, съдържащ натриев хидроксид и натриев хлорид, се подлага на изпаряване в резултатите, тези, които се утаява натриев хлорид (това е много разтворимост мъже Шуй и тя варира малко с температура), кото-Ing отделя и се използва за по-нататъшно електролиза.
Пространството на анодна и катодна е разделена от диафрагма, така че получените продукти не влизат в контакт един с друг, например:
Cl2 NaOH = NaClO NaCl Н 2О
Сода каустик се използва в много индустрии, например за почистване на масло производство сапун на мазнини, Bu хартиената промишленост, в производството на синтетични влакна и багрила, производство на лекарства, и т.н. в ежедневния живот.
По-скъпи продукти - Калиев хидроксид - се използва по-често от NaOH.
Натрий и калий, образуват соли с всички киселини. Почти всички соли са разтворими във вода. Най-важните от тях са, както следва.
* Натриев хлорид NaCl - необходимо подправка на храна, се-използва за консервиране на храни и също е суровина за производство на натриев хидроксид, хлор, солна киселина, сода, и т.н.
Заявление за хляб - виж таблица .. 25, стр. 303.
* Натриев сулфат Na 2SO 4 се използва в производството на стъкло и сода. Кристализира от водни разтвори декахидрат хидрокси
плъх Na 2SO 4 • О 10N2 нарича глауберова сол. Използва се в медицината като очистително.
калиеви соли трябва да бъдат споменати специално, тъй като някои от тях са широко използвани като торове:
1) сурова сол представлява смлян природен сол, за предпочитане минерали sylvinite NaCl • KCl-кай и прежди KCl • MgSO 4 • 3H2 О;
2) концентрирана тора резултат от повторно rabotki природен калиеви соли - е KCl и К2 SO4;
3) дърво и торф пепел, съдържаща калиев карбонат К 2СО 3.
Свързани статии
