Закона на Хенри - studopediya
Количеството газ, разтворен в единица обем от разтвор nazyvaetsyarastvorimostyu: m 3 / m 3 г / л мол / л, и др ...
Разтворимостта на газ в течността определя способността на чист компонент газ или газова смес образуват хомогенни течни разтвори.
Разтворимостта на увеличенията газ с нарастващ натиск:
F, mm Hg. Чл. 102 390 874 1160
г, г / л 10,6 2,74 24,0 31,6
Газът във високата променливост на сила, не може да се разтваря в течността и вече при безкрайно малък равновесие на концентрация е установено "разтвор газ" не е просто разтвор, и с наситен разтвор на даден р и Т.
Процес на разтваряне идеален газ при относително ниски налягания. в отсъствието на химическо взаимодействие на газа с течност, е описан от Хенри (. Уилям uchon.1774-1836 Eng), отворите им през 1803 година, която посочва: "Броят на разтворен газ в течност е пряко пропорционална на налягането му през разтвора при постоянна температура".
където К - константа на Henry, 1 / Pa, 1 / бар, 1 / атм;
р - общо налягане, Pa, бар атм.
В случая, когато чист газ се разтваря (един компонент), стойността на р е равно на общото налягане. и ако газовата смес се разтваря, след това стойността на р ще се характеризира с парциалното налягане (PI) на разтворен газ в течната компонента:
закон на Хенри е специален случай на общия закон на Далтон.
Частичното налягане на компонента в газовата смес, се изчислява по формулата:
където пи - парциално налягане на аз-ти компонент;
P Общо - общо налягане на газовата смес;
Експресия (2) - експресията на Хенри-Dalton право.
Vg / Вл Þ V2 ® обемна фракция на разтворен газ, който за идеален газ е равно на мол (х2) Þ Вследствие на закона на Авогадро. Х2 = KG # 8729; p2.
Изразяване на закона на Хенри Dalton-изписва така:
където Xi - молната фракция на разтворен газ.
Ki - Хенри постоянна-тото газ компонент;
пи - парциално налягане на компонент I-ия газ в сместа.
Уравнение (4) друга форма, с които са познати на много разредени разтвори (ORS). В реалния изключително разредени разтвори на разтворител (x1) е удовлетворено закон Раулт. и за разтваря течно вещество (х2) - право на Хенри.
За течни разтвори на ТНС в течности със сравними налягане на наситени пари Хенри намерено експериментално. При ниски концентрации, парното налягане на разтвора е пропорционална на мол
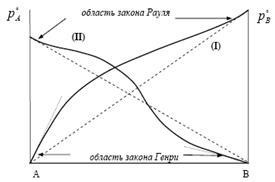
gdekG - емпирични константа (Хенри константа), който има измерение под налягане. Ако сравним изразът 5 от закона Раулт (на г-н Раул Þ ), След това следва chtokG @
Въпреки това, коефициентът на пропорционалност е различно от налягането на наситената пара на чисто вещество: ¹ кг р.о. аз
Хенри константа се определя като наклона на допирателната към кривата на експериментален налягане в зависимост от състава на двойката разтвор когато х2 ®0.
Хенри константа се определя чрез екстраполация на експериментални данни:
Когато x2 ®1, кг ® Р О 2 и получаваме закона на Раул.
Ние сравняваме тези две форми (4)
На практика, разтворимостта на газа не обикновено се изразява в мол фракции, и в единици обем от израза (1). , (6)
Съотношението на разтворимост на налягането (при Т = конст) е Хенри константа:
и има физическа смисъла на коефициента на разтворимост на парциалното налягане на газ, равен на единство, 1 бар, 1 МРа, 1 атм.
разтворимост Мярка газ в течността е коефициентът на разтворимост (а), която показва количеството разтворено в течност (разтвор) при температура газ и налягането данни (Р и Т) условия:
където - коефициент на разтворимост газ (Бунзенова коефициент), т 3 / m 3.
Аналитичният метод експресията на право термодинамична Хенри може да бъде получен от Гибс-Duhem:
където X 1 и X 2 - част от мол на разтворителя (1 - течност) и разтвореното вещество (2 - диоксид);
м 1 и m2 - химични потенциали на разтворителя и разтвореното вещество.
химични потенциали могат да се определят от следните изрази:
където Р1 и Р2 - частичен разтворител и се разтваря газ.
Разнообразяване на експресията (9), на различия от химичните потенциали:
Заместването на експресия (4.10) в оригиналната уравнението на Гибс-Duhem (8):
Изберете dlnp2 от уравнение (11):
Това уравнение може да се превърне тази форма:
Парциалното налягане на пара с идеални свойства за Разтворителят може да бъде определена от закона Раулт и го изразят по отношение на наситен налягане на парите:
Разнообразяване (14) съгласно x1. , това заместване в (13) се получава следното уравнение:
Вземете неопределен интеграл от уравнение (15), с въвеждането на интеграцията константи LNK, където килограм - Хенри постоянно:
След потенциране на израза (4.16) получаваме уравнението на закона на Хенри:
Въз основа на това уравнение, се казва закона на Хенри. "При постоянна температура парциалното налягане на летливия (газообразен) компонент (Р2) е пряко пропорционална на неговата част от мол в течността (х2)".
Тази формулировка право Хенри се отнася за случая, когато разтваря газообразните развива бо ¢ голямо налягане на парите (р о г) в сравнение с налягането на парите на чистия разтворител (р о п), което е типично за газ. В този случай двете разтвор на веществото (газ и разтворител) е химически инертен. кг величини в уравнение (17) е еднакво с парциалното налягане.
Разтворимостта на газове в течности е пряко пропорционална на парциалното налягане на газ (р) по-горе повърхността на течността :.
Хенри константа е константа за и-тия вещество при дадена температура, температура промяна на стойността варира в зависимост от експоненциален закон. Стойностите на К за различни системи са дадени в позоваванията на термодинамичните свойства на веществата.
Като цяло, константа на Хенри зависи от естеството на газа, естеството на разтворителя и температурата.
При високи налягания (над 1¸1.2 МРа), или когато свойствата на несъвършена разтвор газ. които могат да възникнат при относително високи концентрации на разтворен газ в разтворител, по отношение на правото на Хенри се използва вместо летливостта на стойности на налягането:
където FG - летливостта (нестабилност) на газа;
коефициент летливостта което зависи от р и Т. - GF
Принцип на Льо Шателие-Браун. От термодинамична система в състояние на устойчиво равновесие, може да повлияе на външни фактори, то обособяването на тази държава. Системата за реакция за тези ефекти могат да бъдат качествено определя въз основа принцип Льо Шателие-Браун от, предложен през 1884 г. от френския химик Анри Луи Льо Шателие (1850-1936 година), и се установява през 1887 година от немския физик Карл Фердинанд Браун (1850-1918 г х): ".. външни влияния, извеждане термодинамична система от състояние на стабилно равновесие, той причинява да тече процеси, които намаляват въздействието на тези външни смущения"
Свързани статии
