Подготовка за UPE. Химия.
Кратък обзор 5. строежа на атома
История на откриването на строежа на атома
В края на XIX - XX век започва физика доказано, че атомът е комплекс на частиците се състои от прости (елементарни частици). Те са открити:
1. катоден лъч (английски физик Георги. Георги. Thomson, 1897)
2. Частиците, които се наричат електрони Е - (носят един отрицателен заряд);
3. естествена радиоактивност елементи (френски учени - radiochemists Бекерел и физик М. Кюри Кюри Pierre Кюри, 1896) и наличието на а-частици (хелиеви ядра);
4. присъствие в центъра на атом положително заредена ядрото (английски физик и radiochemist Rutherford, 1911);
5. Изкуствен превръщане на един елемент към друг, например азот кислород (Е. Rutherford, 1919 YG). Един елемент на атомното ядро (азот - в експеримента Rutherford) при въздействие с ядро α частици се образува от друг атома (кислород) и нов частиците провеждане единица положителен заряд, наречен протон (ядро)
6. Наличието на електрически неутрални частици в ядрото на атома - неутроните (британски физик J. Chadwick, 1932).
В резултат на проучвания е установено, че атомът на всеки елемент (с изключение на Н) протони присъстват. неутрони и електрони.
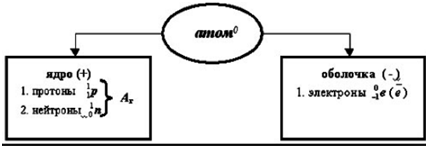
Структурата на атома.
Освен това, протоните и неутроните в ядрото на атома концентрира и електрони - по периферията си (в електронна обвивка).
Броят на протоните в ядрото е равен на броя на електроните в черупката на атома и отговаря на номера на последователност на този елемент в периодичната таблица.
Електрон обвивка на атома
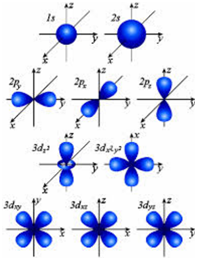
Електрон обвивка на един атом е сложна система. Тя е разделена на черупка с различна енергия (енергийно ниво); нива на свой ред са разделени на подслоя и подслоеве включват атомни орбитали, които могат да варират по форма и размер (обозначени с буквите а, р, D, F и т.н.).
Форма а-орбиталния - сферична. Форма р-орбитали (броят на р-подниво е 3) - гира. Форма D-орбитали (броят на които в съответния под-слой е равен на г-5) - е по-сложно. Още по-трудно да се образуват F-орбитали, чийто брой е по F-подниво е 7.
Формата на атомна орбитала.
Максималният брой на електрони при енергийно ниво се определя от формула N = 2n². Когато n-брой нива на енергия.
Процедурата за пълнене електронен ниво малки периоди атоми
За да бъде верижната структура на електронните обвивки на атомите трябва да се ръководи от следния алгоритъм:
А. определяне на общия брой на електрони в обвивката от поредния номер;
Б. определя броя на енергийните нива за броя на периода;
Б. определя броя на електрони при всяко ниво на енергия (като се използва формула 2n²)
G. върху външната електрони обвивка на основните елементи в подгрупа количество от електрони, съответстващи на номера на група;
D. от преход група елементи на външния слой 2, електронен д, е изпълнен предпоследния електрон слой.
водороден атом има номер на последователност 1 по този начин е един електрон. Atom е един период от време, следователно, на нивото на енергията на един атом. Схема разпределението на електроните върху енергийните нива:
)
Напиши атомен заряд ядро, а след това сложи скоба символизираща електронен ниво в близост до долния десен конзолата напишете броя на електроните на дадено ниво.
Разпределението на електроните върху нивата на енергия могат да бъдат написани по различен начин:
Хелий атом има номер на последователност 2 следователно има две електрон. Atom е един период от време, следователно, на нивото на енергията на един атом. Схема разпределението на електроните върху енергийните нива:
Той + 2) 2, или
литиев атом има номер на последователност 3 следователно има три електрон. Три от електрона не може да се побере на първо ниво на енергия, тъй като Тя е равна на максималната му 2е капацитет (ccording формула 2n²). Следователно, третият слой електрон образува втора енергия. Този слой ще има по-голям радиус от първото. Това наистина съответства на позицията на лития в периодичната таблица на химичните елементи. Атом е в периода 2, следователно, две енергия в нивото атом. Схема разпределението на електроните върху енергийните нива:
Li + 3) 2) 1, или
Спор по този начин, помислете схемата за пълнене на енергийните нива на някои елементи от малките периоди:
Свойства на елементи са периодично повтарящи защото атомите на елементите се повтарят периодично броя на електроните в външен електронен слой.
Процедурата за пълнене електронен ниво дълги периоди атоми
Съставът на втория и третия период включва 8 бр. Структурата на четвъртия период включва 10 елемента е по-голяма от, т.е. четвъртия период включва 18 елемента. Къде електроните са поставени в елементите следните калций? Припомнете си, че елементи от група Б - метали, които се характеризират с валентност II. Единственото нещо, което може да се предложи - да продължи попълването на предпоследния електронен слой. Така че, за скандий може да осигури следния модел на атомната структура:
Sc 21))))
08 февруари 09 февруари
Десет "допълнителни" елементи на четвъртия период са завършени цинк атом. На външния слой на електронен елемент е два електрона, и на предпоследната - 18.
Zn 30))))
08 февруари 18 февруари
Поради факта, че предпоследния слой в електронните елементи на четвъртия период може да се позиционира повече електрони 10 в четвъртия период от 10 химични елементи е по-голяма от третия.
изводи:
1. броя на слоевете в номер атом електронен елемент, равен на периода, в които активният елемент.
2. брой групи от елементи на групата, към която елементът е равен на броя на външните електрони на атома.
3. Периодичните повторяеми свойства на елементи, свързани с факта, че атомите в прехода от един период на нови електронни започва да запълни слой, който се повтаря периодично брой външни електрони към външен електронен слой.
4. Наличие на дълги периоди се дължи на електрона пълнене предпоследната (вътрешни) електронни слоеве.
Графично схема на електронната структура на атома на слоя (катод графичен формула)
За да се опише подредбата на електрони в атомна орбитала се използват електронни конфигурация.
За писането си в ред орбитали са написани на легендата (s-, р-, D-, F-орбитали), а пред тях, което показва броя на енергийно ниво. Колкото по-висока е цифрата, толкова по-далече е електрона от ядрото. В горния случай, определянето на орбитална брой писмено електрони в този орбитален.
Електронни конфигурация на скандия атома.
ниво на външна енергийна Електроните се наричат валентност.
Тя се отнася до d-елементи.
Графично, разпределението на електроните в атомна орбитала могат да бъдат представени под формата на клетки.
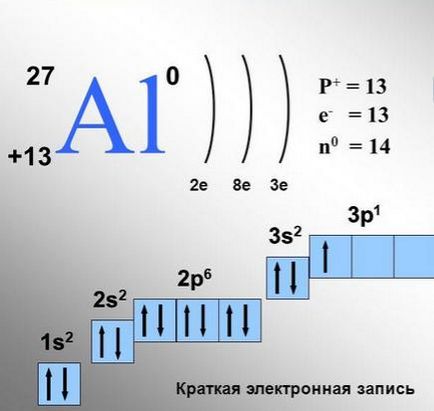
Разпределението на електрони в атома на алуминий.
Всяка клетка отговаря на един орбитален. За р-орбиталния на такива клетки ще бъде три, за г-орбитали - пет до седем F-orbitali-. В една клетка може да бъде 1 или 2 електрони.
Има общо (наречен правило Gunda) при което електрони предпочитат да се утаи на същата енергия орбитали пълненето на тези орбитали започват (например, три р-орбитали) са първи индивидуално, и само когато всеки от тези орбитали е вече един електрон, Второто електрони.
Когато населен орбитална два електрона, тези електрони се наричат сдвоени. Електроните ги обитават, така че всеки един от тези р-орбитали ще бъде един електрон. Те отдават това на факта, че електроните в съседните клетки малко отблъскват взаимно, както като заредени частици.
Подготовка на изпитванията за външно тестване:
подготовка Онлайн тест за външно тестване на химията №5 "атомна структура"
